前不久,住友制药肿瘤公司宣布,美国食品和药物管理局(FDA)授予TP-1287(一种用于治疗尤因肉瘤(Ewing sarcoma)的研究性口服CDK9抑制剂)孤儿药资格认定。
住友制药肿瘤公司首席执行官兼全球肿瘤负责人Patricia S.Andrews表示:“我们很高兴TP-1287获得这一资格认定,突显出尤因肉瘤患者需要更多治疗选择。我们认识到在这种疾病对新型治疗的需求尚未得到满足,我们很高兴能够为这项研究的进展做出贡献,以帮助改善患者的预后。”
美国食品和药物管理局(FDA)的“孤儿药物资格认定”授予用于治疗罕见疾病或症状的研究性疗法,这些疾病或症状影响美国不到20万人。尤因肉瘤是一种罕见癌症,发生在骨骼或骨骼周围软组织中。当细胞的DNA发生变化,导致细胞快速繁殖和异常细胞肿瘤,入侵和破坏健康的身体组织时,就会发生这种疾病。异常细胞可以在全身分解和转移。尤因肉瘤可以发生在任何年龄,尤其是可能发生在儿童和青少年身上。
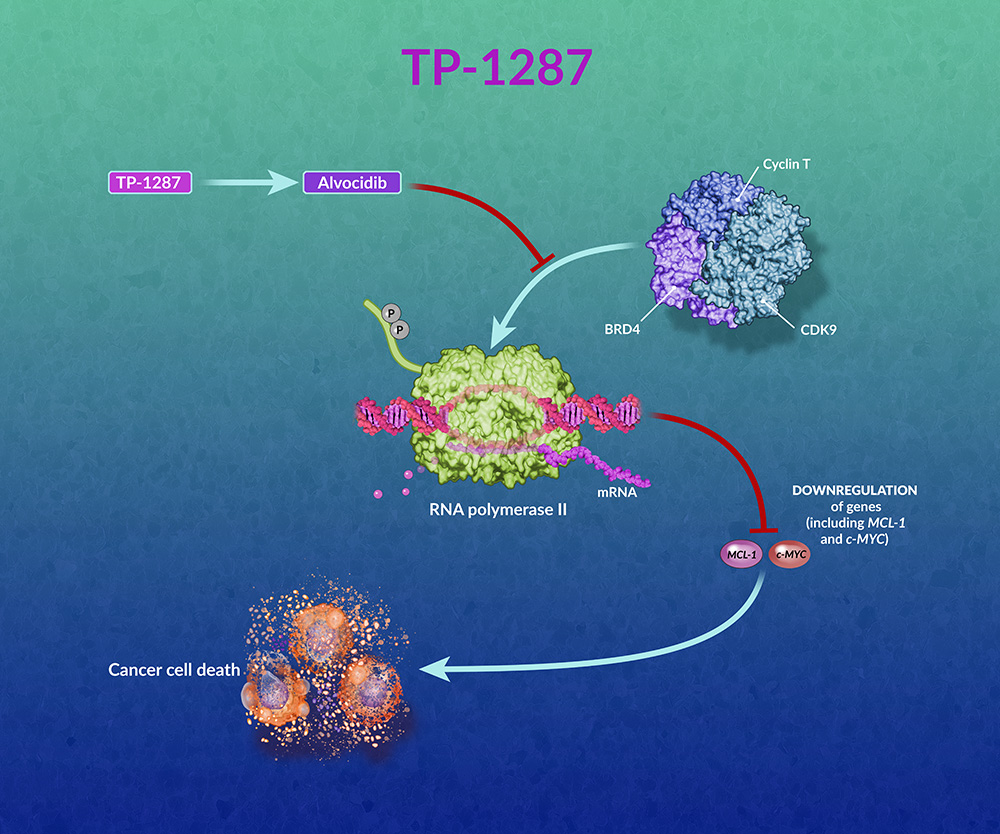
“TP-1287对包括CDK9在内的细胞内激酶表现出强大的抑制作用。CDK9抑制导致关键抗凋亡蛋白(如MCL-1)的下调,而MCL-1下调又被证明在血液恶性肿瘤和几种肿瘤类型的临床前模型中可抑制肿瘤生长,”住友制药肿瘤公司首席医学官Jatin J.Shah详细介绍到。
TP-1287还被FDA授予儿科罕见病资格认定,用于治疗尤因肉瘤。儿科罕见病是指严重或危及生命的疾病,这些疾病主要影响出生至18岁的患者。
TP-1287目前正在美国进行的一项针对晚期转移性或进行性实体瘤患者的首次人体1期研究中进行评估,这些患者对已知的能为其病情提供临床益处的既定疗法具有难治性或不耐受性。
这是住友制药肿瘤有限公司从去年到现在获得的第四个孤儿药资格认定。DSP-5336是该公司的专有研究性小分子抑制剂,可抑制Menin与混合谱系白血病(MLL)蛋白的结合,授予治疗急性髓系白血病的孤儿药资格认定。TP-3654是该公司专有的口服研究性PIM激酶抑制剂,授予治疗骨髓纤维化的孤儿药资格认定。DSP-0390是一种研究性的emopamil结合蛋白(EBP)抑制剂,授予治疗脑癌的孤儿药资格认定。这些资格认定展现出SMP肿瘤学的实力和多样性,以及对肿瘤学研发的承诺。
| 关于TP-1287
TP-1287是一种研究性CDK9抑制剂alvocidib的口服磷酸盐前药。TP-1287经酶促水解产生alvocidib。alvocidib在CDK9的ATP结合位点结合,通过CDK9阻止磷酸化。这种结合阻止了c-MYC和MCL-1等基因中的有效转录,并导致信使RNA (mRNA)减少。c-MYC和MCAL-1转录的下调导致多种肿瘤细胞凋亡。TP-1287目前正在1期、开放标记、剂量递增、剂量扩展、安全性,药物动力学和药效学研究中进行评估,目的是确定晚期转移性或进行性实体瘤患者口服TP-1287的最大耐受剂量(MTD)和剂量限制毒性(DLT)。
原文标题:
Sumitomo Pharma Oncology Receives Orphan Drug Designation for TP-1287, an Investigational Oral CDK9 Inhibitor for the Treatment of Ewing Sarcoma
译:黄娟