美国食品和药物管理局(FDA)已经批准了sodiumphenylbutyrate/taurursodiol(PB/TURSO;Relyvrio,Amylyx Pharmaceuticals)作为一种治疗肌萎缩侧索硬化(ALS)的新药,这是5年来首个获批用于ALS的新药。

Relyvrio获批历程 最初,在今年3月FDA外周和中枢神经系统药物咨询委员会因为Relyvrio没有足够的疗效证据,未通过该药物的批准,但这个结果受到了患者和其他支持倡导者的批评,因为他们认为FDA并没有考虑医疗需求以及疾病的严重性和致命性,之后制造商也提交了新的数据分析和新的生物标志物数据,因此,FDA推迟了对该药物批准的最终裁决。于当年9月初重新召集专家组进行第二次审查,这次终于以7:2的结果获得该药物的批准。 支持倡导战胜科学? 关于这种药物的消息受到了患者和支持倡导者的欢迎。不过,有人对此表示担心,因为这一决定似乎标志着患者权益在药物审批过程中的作用越来越大。 Alexander教授认为目前没有该产品的证据,他担心在某些情况下宣传胜过科学,FDA必须确保有适当的保障措施,以便科学正确引领,科学家和监管机构要做的就是在迷雾中把握方向。 Lendnal 教授反驳说,如果一种药物是安全有效的,并且是针对一种治疗方案很少的严重疾病,那么患者在药物批准过程中的支持就会发挥作用。 通常情况下,FDA批准需要两项大型研究或一项对生存具有“非常有说服力”影响的研究。 其中一项研究是基于一项多中心、2期的AMX0035 CENTAUR研究【1】。由于PB/TURSO可延长ALS患者的生存期,减缓功能下降。正如Medscape Medical News先前报道的那样,研究人员发现,与服用安慰剂的患者相比,接受PB/TURSO治疗的患者功能下降速度要慢25%(一般认为20%或以上的变化有临床意义)。
在该研究中中,将137名症状发作≤18个月明确患有ALS的成年患者,并且肺活量下降大于预测值的60%,按照2:1的比例随机分为PB/TURSO组和安慰剂组,为期6个月。完成随机治疗的患者可以进入开放标签扩展(open-label extension,OLE)阶段,并接受长达30个月的PB/TURSO药物治疗。在从2020年7月开始的整个研究期间,将以下关键事件的发生作为CENTAUR研究的疗效结果进行评估:死亡(全因)、气管切开术(呼吸窘迫或气道廓清),永久辅助通气(permanent assisted ventilation,PAV)(无创通气超过7天且每天>22小时),以及首次住院【因ALS的相关操作(放置饲管、气管造口术以管理分泌物或呼吸支持,或膈肌起搏系统)或因与ALS进展或并发症相关的不良事件而住院】。 在随机分组到分析截止日期的时间内(最长的术后随访时间为35个月),最初随机接受PB/TURSO组的患者发生任何关键事件的风险降低47%(HR=0.53, 95%CI 0.35~0.81),差异有统计学意义(p=0.003);无事件持续时间中位数(四分位间距)分别为14.8(6.5-29.1)月和10.0(4.0-15.0)月(figure 1A)。最初随机接受PB/TURSO治疗的患者死亡或气管切开术/PAV的风险降低49%(HR=0.51,95%CI 0.32~0.84),差异有统计学意义(p=0.007),气管切开术/无PAV生存期中位数(四分位间距)分别为25.8个月(14.8-33.6个月)和18.5个月(11.7个月-未达到)(figure 1B)。最初随机接受PB/TURSO组的首次住院风险降低了44%(HR=0.56,95%CI 0.34~0.95),差异有统计学意义(p=0.03);最初随机接受PB/TURSO组的中位(四分位间距)无住院时间尚未达到(6.9个月-未达到),而最初随机接受安慰剂组中位数(四分位间距)为14.1个月(4.2个月-未达到)(figure 1C)。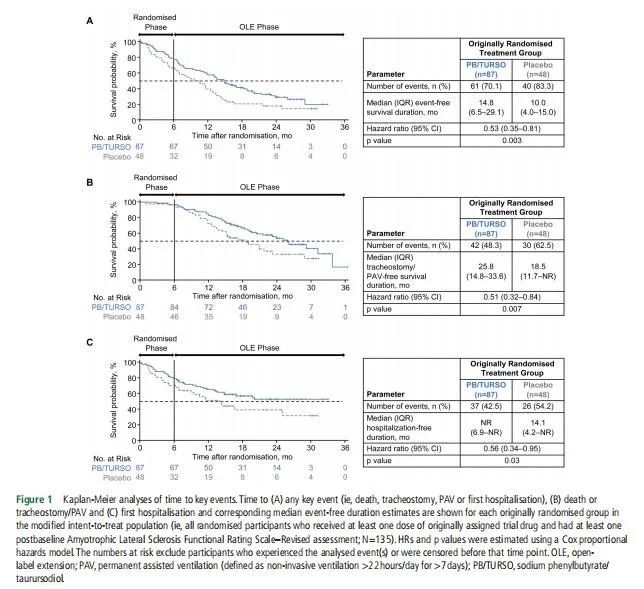
在CENTAUR的长期研究中,最初随机分配至PB/TURSO组的患者发生死亡、气管切开术、PAV和首次住院等关键事件的风险显着低于最初随机分配至安慰剂的患者,其中大多数人在OLE阶段继续接受PB/TURSO治疗,并且发现PB/TURSO对ALS疾病进展的修饰作用。早期给予患者PB/TURSO治疗延长了气管切开术/无PAV的生存期,并降低了ALS患者的住院风险,从而潜在减少了患者个人健康负担。 目前,Amylyx还有一项正在进行的为期48周的国际性安慰剂对照的AMX0035 PHOENIX 3期临床试验。
在ALS的AMX-3500研究(CENTAUR)中,完成24周随机阶段(NCT03127514)的参与者(PB/TURSO,n=89;安慰剂,n=48)有资格参加OLE阶段(NCT03488524)并接受PB/TURSO(≤132周,第24周报道)。AMX-8000研究(PEGASUS;NCT03533257)是一项为期24周的随机试验,研究对象是患有AD或轻度认知障碍的成人(PB/TURSO,n=51;安慰剂,n=44)。PB/TURSO的安全性和耐受性是这两项试验的主要目标。 CENTAUR和PEGASUS的平均年龄Mean(SD)分别为57.7(9.6)岁和70.7(7.5)岁。在CENTAUR随机阶段,治疗中出现的不良事件发生率在各组之间相似,PB/TURSO组为97%,安慰剂组为96%;77%的人在OLE阶段发生不良事件≥1次。在PEGASUS研究中,PB/TURSO组和安慰剂组中的不良事件发生率分别为67%和59%。在CENTAUR的初始PB/TURSO暴露(≤3周)期间,胃肠道不良事件更常见,并且胃肠道反应是PEGASUS中PB/TURSO相关不良事件的主要原因。PB/TURSO的心脏事件发生率较低,CENTAUR中心脏事件发生率为8%,PEGASUS中为4%,并且在两项研究中,基线时各组的心电图结果相似,在治疗过程中未观察到具有临床意义的变化。 这些发现支持ALS和AD中的PB/TURSO安全性概况,在两项试验中,PB/TURSO和安慰剂之间的不良事件发生率大概相似。在AD患者中的发现进一步阐明了PB/TURSO的安全性,因为CENTAUR中的不良事件似乎主要是由于疾病导致的。 在9月的第二次委员会审查听证会上,Amylyx制药公司的官员表示,如果PHOENIX试验未能证明有效,该公司将撤回该药物。然而,该公司并没有被法律要求撤下该药物,而且FDA将一种产品撤出市场的过程十分复杂。并且,公司也一直没有公开这个药物的定价,一方面,我们不能 100% 确定它完全有效,另一方面,即使药物有效,但是如果定价昂贵也是很荒谬的。
药物相关说明 Relyvrio 可以溶解在8盎司室温水中冲服,也可以通过饲管给药, 前3周的推荐剂量是每天一包(3克苯丁酸钠和1克牛磺二醇),3 周后,剂量增加到每天两次,每次一包,餐前服用,最常见的不良反应是腹泻、腹痛、恶心和上呼吸道感染。Relyvrio 含有牛磺二醇,是一种胆汁酸,干扰胆汁酸循环,可能会导致患有该病的患者腹泻恶化,在服用 Relyvrio 之前应考虑咨询专家。