胱氨酸症是一种罕见的遗传性隐性疾病,主要因为胱氨酸在溶酶体中积累引起,表现为眼部并发症(如严重的畏光症)、肌肉萎缩和肾功能衰竭。胱氨酸病的患病率为 1/100000至 1/200000,且超过90%的接受治疗胱氨酸病患者需要在第20-30年进行肾移植。目前针对胱氨酸症的标准治疗需要患者每天服用数十种药,但对阻止疾病进展的效果甚微,只是为了活下去,但副作用(例如口臭或不适的胃肠道症状)还会降低持续服药的依从性。
这是一种无情的疾病,迫切需要新的治疗方式。随着基因疗法的开展,不断有新的疗法和药物为患者带来新的希望。近日,AVROBIO, Inc. (Nasdaq: AVRO)宣布美国FDA已将儿科罕见病资格认定(RPDD)指定给AVR-RD-04,用于开发胱氨酸病的基因疗法。
AVR-RD-04是一种慢病毒载体递送的基因疗法,旨在对患者自身的造血干细胞进行基因修饰,采用单剂量注射患者自身造血干细胞的方式,来阻止或逆转胱氨酸症,以表达编码胱氨酸蛋白的基因,减少胱氨酸在细胞内溶酶体中的积累,从而减轻胱氨酸病的症状。
该疗法正在加州大学圣地亚哥分校进行的1/2期临床试验的初步数据表明,耐受性良好,迄今为止没有报告与药品相关的不良事件(AE),所有报告的AE都与清髓调节、干细胞动员、潜在疾病或患者原有疾病有关。大多数AE为轻度或中度,无临床后遗症消退。迄今为止的临床数据表明,该疗法在评估的多种组织中具有益处,包括眼睛、皮肤、胃肠黏膜和神经认知系统。
早在2020年3月,AVR-RD-04已获得美国FDA颁发的孤儿药(ODD)称号,这次获得RPDD将更有助于该疗法进一步快速的成长,该资质基本原则与ODD相似,旨在促进用于预防和治疗儿科罕见病的新药和生物制剂的开发。获得RPDD的新药申请(NDA)或生物制剂许可证申请(BLA)批准的公司可能有资格获得额外的激励举措,以便优先审查其他产品的后续营销申请,从而促进儿科罕见病领域的新药研发进展。优先审核凭证可由公司使用或出售给第三方。
获得RPDD认定必须满足三个主要标准:
该药物必须适用于儿科罕见病的预防或治疗;
具有充分的资料或患病率数据,能证明药物适用的儿科罕见病或病症满足罕见标准;
具有充分的支持性数据,能证明该药物对于儿科罕见病或病症有疗效。

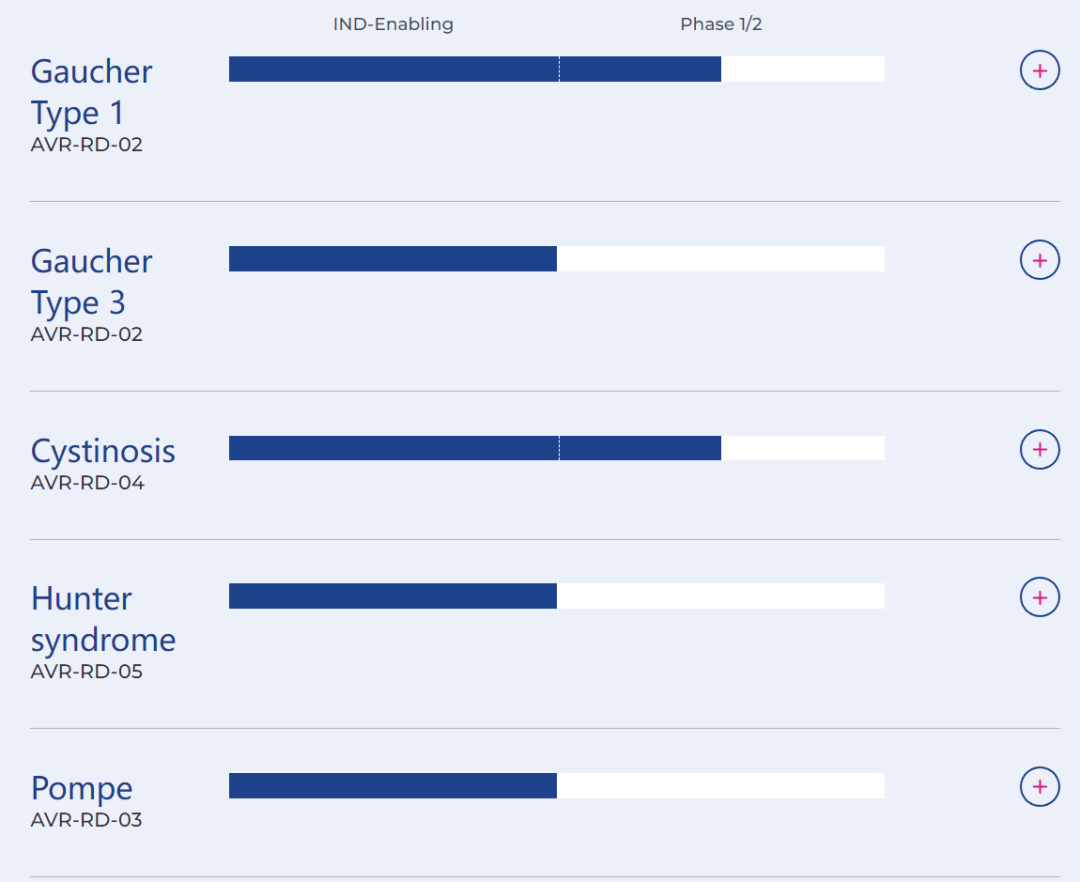
AVROBIO是一家领先的临床阶段基因治疗公司,旨在用单剂量停止或逆转疾病的基因疗法,为溶酶体疾病患者提供终身自由。公司的研究性疗法目前正在1型戈谢病(又称葡糖脑苷脂病)和胱氨酸病的临床试验中进行研究,同时还在推进一项关于戈谢病3型、庞贝病和亨特综合征(又称膝状神经节炎)的计划。
信息参考:
https://www.avrobio.com/