9月29日,Mirum Pharmaceuticals宣布美国FDA已批准Livmarli (maralixibat)口服溶液上市,用于治疗1岁及以上Alagille综合征(ALGS)患者的胆汁淤积性瘙痒。这是FDA批准的首个也是唯一一个治疗这种罕见肝病的药物,这一疾病影响美国2000-2500名儿童。

Alagille综合征 (ALGS) 是一种罕见的遗传性疾病,因患儿胆管异常狭窄、畸形和数量减少导致胆汁在肝脏中积聚,最终导致肝病进展。ALGS肝损伤引起的体征和症状包括黄疸(皮肤发黄 )、黄疣(破坏皮肤下的胆固醇沉积物)和瘙痒症(痒)。其中,瘙痒症是所有慢性肝病中最严重的,并且大多数受影响儿童3岁就会出现此症状。据估计,每30000个人中就有一人患ALGS。根据最近的报告,60%至75%的ALGS患者在成年之前进行了肝移植。
Livmarli是一种每日口服1次的回肠胆汁酸转运体(IBAT)抑制剂,通过抑制IBAT的再摄取改变胆汁酸的流向,阻断胆汁酸在肝脏的再循环,增加粪便胆汁酸排泄来防止胆汁酸在肝脏的积聚。
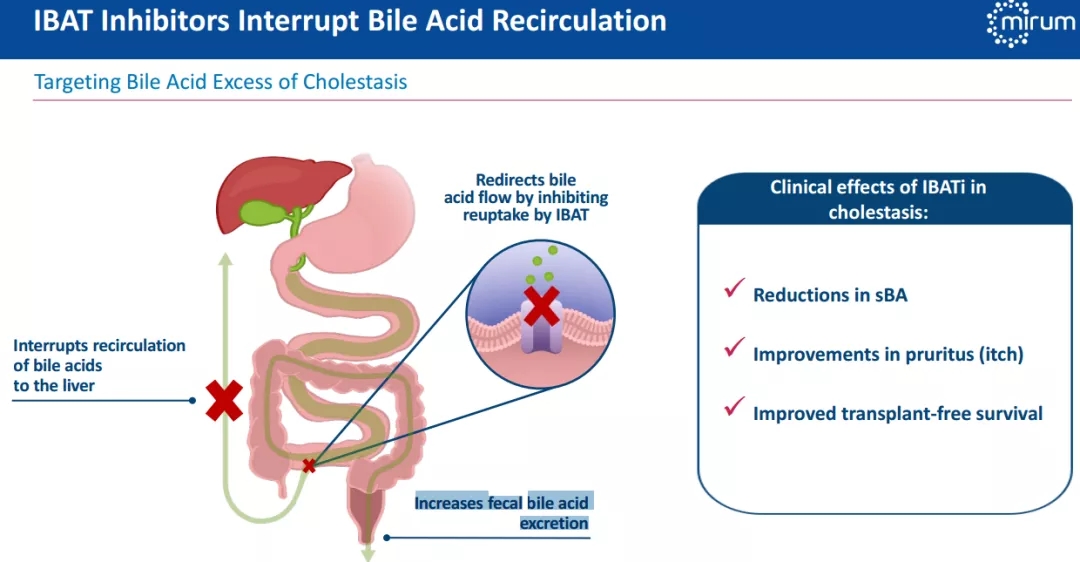
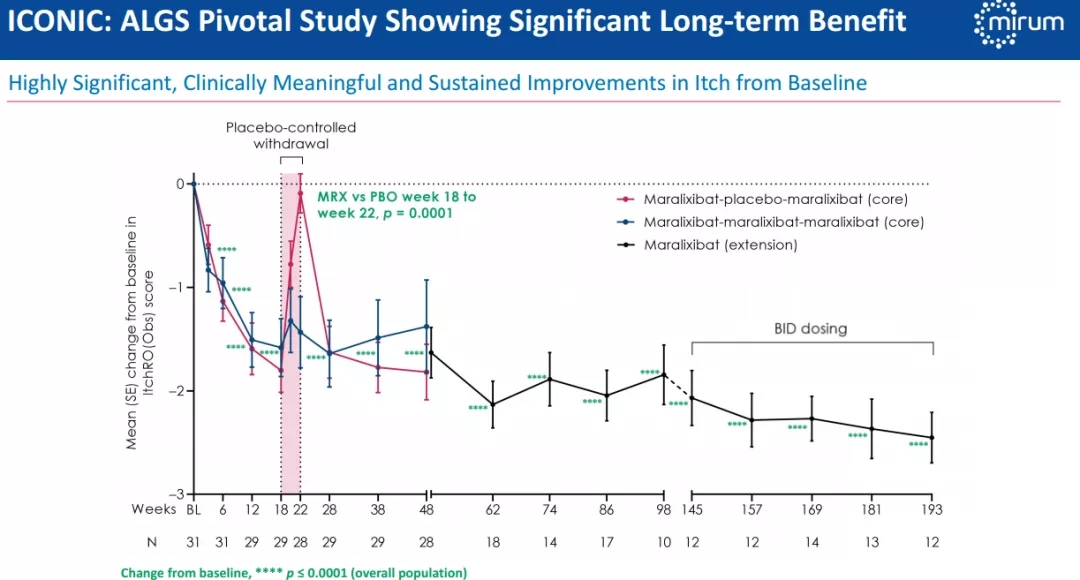
Livmarli的批准基于关键ICONIC研究数据支持,与安慰剂相比,患者瘙痒症状在统计学上显著减少,并且持续了4年。
Mirum 总裁兼首席执行官 Chris Peetz 说:“今天对于 Alagille 综合征社区来说是美好的一天,因为这一急需的新的疗法的批准,将解决这种疾病最令人衰弱的影响之一。今天对于Mirum来说也是具有里程碑意义的一天,因为我们在开发可能改变生命的罕见肝病药物方面取得了进展。”
版权声明:本网站所有注明“来源:罕见病信息网”的文字、图片和音视频资料,版权均属于罕见病信息网网站所有。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。