2021年第三季度,FDA共批准14款新药,包括7个新分子实体,5个新生物制品,1个细胞疗法,1个疫苗,生物制品有5种。
2021年Q3 FDA批准的新药
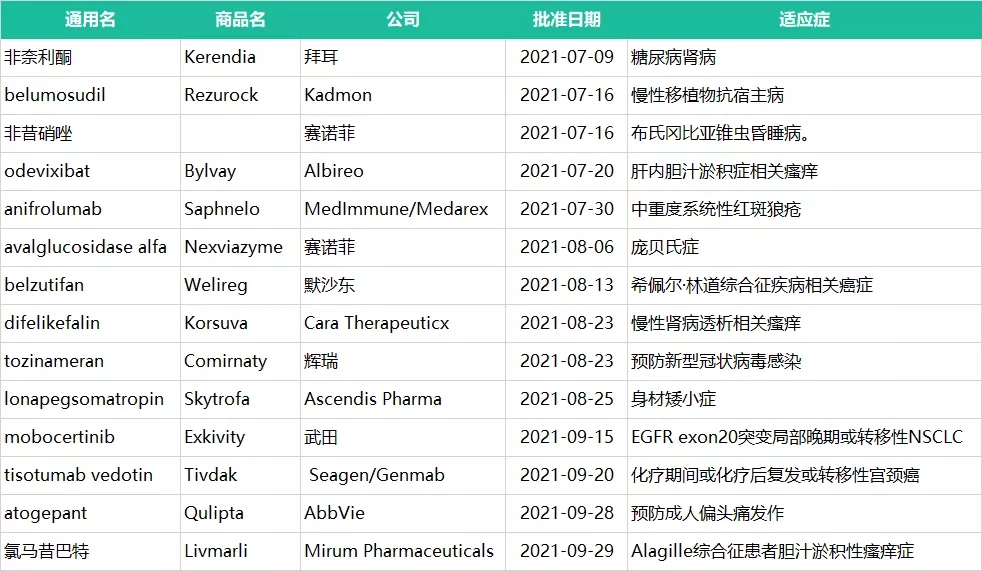
非奈利酮
7月9日,FDA批准拜耳公司Kerendia (非奈利酮)上市,用于降低合并慢性肾病(CKD)的2型糖尿病患者的肾小球滤过率(eGFR)的下降、终末期肾病、心血管死亡、非致死性心肌梗塞,以及因为心力衰竭住院的风险。
非奈利酮是第三代新型高选择性、非类固醇皮质激素受体拮抗剂(MRA)。相较第一代和第二代MRA,它具有更高的盐皮质激素受体特异性和亲和力,可以选择性与盐皮质激素受体结合。
非奈利酮是第一个在慢性肾病和II型糖尿病患者中证明降低肾和心血管风险的非甾体类、选择性盐皮质激素受体拮抗剂。
Belumosudil
7月16日,FDA批准Kadmon公司belumosudil上市,用于治疗先前接受过至少2种系统疗法治疗失败的慢性移植物抗宿主病(cGVHD)儿科(年龄≥12岁)和成人患者。这是FDA批准的首款ROCK2抑制剂。
Belumosudi是一种口服的选择性Rho相关卷曲螺旋蛋白激酶2(ROCK2)抑制剂,通过减轻STAT3的磷酸化,加强STAT5的磷酸化,从而下调过度活化的T辅助细胞(Th17),增强调节性T细胞的功能,重新建立免疫平衡。Belumosudi此前获得了FDA授予的突破性疗法、孤儿药和优先审评资格的认定。
非昔硝唑
7月16日,FDA批准赛诺菲非昔硝唑(Fexinidazole)上市,用于治疗6岁及以上且体重至少20kg的布氏冈比亚锥虫昏睡病(HAT,人类非洲锥虫病)患者。这是首个获批治疗昏睡病的口服药物。
非昔硝唑是一种DNA合成抑制剂。昏睡病现有治疗方法包括肌肉注射喷他脒(Pentamidine)或静脉输注二氟甲基鸟氨酸(Eflornithine)。口服疗法的便利性对于治疗昏睡病很重要,赛诺菲凭借此次批准也获得了一张优先审评券。
Odevixibat
7月20日,FDA批准Albireo公司odevixibat上市,用于治疗3个月以上进行性家族性肝内胆汁淤积症患者瘙痒。odevixibat是FDA批准的首款用于这类患者群体的疗法,无需冷藏,作为胶囊或撒在食物上每日1次服用。
PFIC是一种罕见的儿童疾病,可导致进行性、危及生命的肝脏疾病,主要症状为持续和强烈的瘙痒,严重影响患者生活质量。多数情况下,PFIC患者在10年内进展为肝硬化和肝功能衰竭。Odevixibat是一款有效的,非全身性回肠胆汁酸转运抑制剂(IBATi),仅在小肠局部起效。此前曾获FDA授予的优先审评、快速通道、罕见儿科疾病和孤儿药资格认定。
anifrolumab
7月30日,FDA批准阿斯利康的I型干扰素拮抗剂anifrolumab上市,用于治疗正在接受标准治疗的中度至重度系统性红斑狼疮(SLE)成人患者。anifrolumab是首个靶向I型干扰素受体(IFN)的抗体,是继2011年Benlysta(贝利尤单抗)之后FDA批准的唯一一款治疗SLE的新药。
I型干扰素受体,如IFN-α、IFN-β 和 IFN-κ ,是参与调控SLE炎症通路的细胞因子,在狼疮的病理生理学中起着核心作用,I型IFN信号的增加与疾病活动度和严重程度增加相关。anifrolumab是一种全人源单克隆抗体,可与 I 型 IFN 受体的亚基 1 结合,阻断 I型 IFN 的活性。
avalglucosidase alfa
8月6日,赛诺菲的avalglucosidase alfa(商品名:Nexviazyme)获得美国FDA批准上市,用于治疗1岁及以上患者治疗晚发型庞贝氏症。此前FDA授予Nexviazyme治疗庞贝病突破性疗法资格和快速通道资格。
Nexviazyme是一种高效酶替代疗法,可以靶向6-磷酸甘露糖(M6P)受体,来改善细胞酶摄取、提高靶组织中的糖原清除率,帮助减少糖原积累。Nexviazyme将GAA酶运输到细胞内溶酶体的关键途径是通过M6P受体实现的。
belzutifan
8月13日,默沙东的口服低氧诱导因子-2α (HIF-2α)抑制剂Welireg(belzutifan)获得美国FDA批准上市,用于治疗希佩尔·林道综合征 ( von Hippel-Lindau,VHL) 相关癌症,包括肾细胞癌(RCC)、中枢神经系统(CNS)血管母细胞瘤或胰腺神经内分泌肿瘤(pNET),这些患者不需要立即手术。此前FDA授予Welireg治疗该适应证突破性疗法资格。
Welireg是FDA批准的首个HIF-2α抑制剂疗法。通过抑制HIF-2α,Welireg可降低与细胞增殖、血管生成和肿瘤生长相关的HIF-2α靶基因的转录和表达。
difelikefalin
8月23日,Cara Therapeutics和Vifor Pharma联合宣布美国FDA已批准difelikefalin(Korsuva)上市,用于接受血液透析的成人慢性肾病患者的中重度瘙痒症。这是FDA批准的首个也是唯一一个治疗慢性肾病相关瘙痒患者的疗法。此前FDA授予difelikefalin治疗该适应证突破性疗法资格。
Difelikefalin是一款first in class高选择性k阿片受体(KOR)完全激动剂,能够抑制产生瘙痒的外周神经元的活性,并且对其他受体(包括mu或delta阿片类受体)、离子通道或转运体无显著活性。另外,不同于小分子KOR激动剂,Korsuva是一款小型合成肽,主要激活外周神经元(PNS)和免疫细胞表达的KORs。
2018年5月23日,Vifor Pharma获得Cara Therapeutics的difelikefalin除美国、日本、韩国之外其它地区的全球许可,总额高达5.4亿美元。
tozinameran
8月23日,FDA正式批准了BioNTech/辉瑞的mRNA疫苗Comirnaty,这也是首个获得监管部门正式批准的mRNA新冠疫苗。此前Comirnaty已获得FDA的紧急使用授权,今年第二季度销售收入达到78亿美元,今年上半年累计销售额113亿美元。辉瑞预计Comirnaty全年将实现约335亿美元的收入。
FDA此次批准是基于去年12月获得紧急使用授权时数千人的临床数据基础之上又对22000多名接种者的临床数据进行了安全性和有效性分析,根据临床结果显示,Comirnaty在预防COVID-19疾病方面有91%的有效性。Comirnaty的常见不良反应包括注射部位反应、疲劳、头痛、肌肉或关节痛、寒冷、发热、注射部位膨胀等。
lonapegsomatropin
8月25日,FDA批准Ascendis公司TransCon人生长激素(lonapegsomatropin )上市,用于治疗儿童生长激素缺乏症(PGHD)导致的身材矮小症。这是美国FDA批准的首个可以每周1次注射的长效生长激素产品。与每天注射相比,每周注射可以减少86%的注射天数。
TransCon人生长激素利用“暂时性连接”技术,以可控方式释放未经修饰的人生长激素,保持人生长激素原有的药理作用。TransConTM分子包括3个部分:未经修饰的原型药物,保护原型药物的惰性载体分子和将两者暂时连接起来的连接结构。当3部分结合后,载体分子可以使得原型药物失活并且保护其不被人体清除。当注射至人体内,在生理条件的pH和体温下,有活性的、未经修饰的原型药物将以可控的方式释放出来。由于原型药物是未经修饰的,因此可以保持其原有的作用机制。
2019年3月6日,维昇药业,获得Ascendis Pharma的独家授权,负责Ascendis Pharma旗下的内分泌罕见病治疗方案在大中华区的开发和推广。
mobocertinib
9月15日,FDA加速批准武田公司Exkivity (mobocertinib) 上市,用于治疗携带EGFR 20号外显子插入突变并且接受铂类药物化疗后疾病进展的局部晚期或转移性NSCLC成人患者。这是美国批准的首个针对EGFR Exon20插入突变的口服疗法。此前,mobocertinib同时获得了FDA和CDE的突破性疗法认定。今年7月,武田在中国提交的新药上市申请获CDE受理,被授予优先审评资格。
由于EGFR 20号外显子插入突变阳性非小细胞肺癌无法用传统的EGFR酪氨酸激酶抑制剂(TKI)进行有效靶向, 有效治疗手段匮乏,mobocertinib凭借一项小规模的I/II期临床试验(NCT0271611)数据获得了FDA的加速批准。Mobocertinib是一款口服酪氨酸激酶抑制剂(TKI),专门设计用于选择性靶向表皮生长因子受体(EGFR)20号外显子插入突变。
tisotumab vedotin
9月20日,Genmab/Seagen的tisotumab vedotin获得FDA加速批准上市,用于治疗化疗期间或化疗后复发或转移性宫颈癌。这是FDA批准的第一个靶向组织因子(tissue factor,TF)的抗体药物偶联物。
Tivdak是结合Genmab靶向TF单克隆抗体,与SeagenADC技术构建的ADC,将细胞毒性药物MMAE通过一种可被蛋白酶切割的连接子偶联在单克隆抗体上,被细胞内吞后释放MMAE,扰乱分裂的细胞微管网络,导致细胞周期停滞和细胞死亡。组织因子是一种表达于多种实体瘤肿瘤细胞的膜蛋白,与肿瘤生长、血管生成、转移和临床预后较差相关。
atogepant
9月28日,FDA批准AbbVie公司Qulipta (atogepant)上市,用于预防性治疗成人偏头痛急性发作。Atogepant是首个获批用于预防性治疗偏头痛的口服小分子CGRP受体拮抗剂。
此批准基于关键III期ADVANCE试验 (NCT03777059),IIb/III期试验(NCT02848326 )和III期长期安全性试验(NCT03700320)的数据,atogepant相较于安慰剂显著降低月平均偏头痛天数。
氯马昔巴特
9月30日,FDA批准Mirum Pharmaceuticals公司Livmarli (氯马昔巴特)上市,用于治疗Alagille综合征(ALGS)患者胆汁淤积性瘙痒症。这是FDA批准的首个也是唯一一个治疗这种罕见肝病的药物,这一疾病影响美国2000-2500名儿童。
Alagille综合征 (ALGS) 是一种罕见的遗传性疾病,因患儿胆管异常狭窄、畸形和数量减少导致胆汁在肝脏中积聚,最终导致肝病进展。ALGS肝损伤引起的体征和症状包括黄疸(皮肤发黄 )、黄疣(破坏皮肤下的胆固醇沉积物)和瘙痒症(痒)。其中,瘙痒症是所有慢性肝病中最严重的,并且大多数受影响儿童3岁就会出现此症状。根据最近的报告,60%至75%的ALGS患者在成年之前进行了肝移植。
Livmarli是一种每日口服1次的回肠胆汁酸转运体(IBAT)抑制剂,通过抑制IBAT的再摄取改变胆汁酸的流向,阻断胆汁酸在肝脏的再循环,增加粪便胆汁酸排泄来防止胆汁酸在肝脏的积聚。
今年4月29日,北海康成与Mirum制药签订协议,获得在大中华区针对Alagille综合征、进行性家族性肝内胆汁淤积(PFIC)和胆管闭锁(BA)开发和商业化Maralixibat的独家授权,支付1100万美元预付款,未来还将支付研发、注册和商业化里程金合计最高1.09亿美元,以及基于产品净销售额可观的双位数的梯度特许权使用费。