
癫痫(图片来源:biospace.com)
Marinus Pharma是一家致力于开发创新疗法治疗癫痫疾病的制药公司。近日,该公司宣布,欧洲药品管理局(EMA)人用医药产品委员会(CHMP)已批准了加速评估其先导候选药物ganaxolone的请求,用于治疗与CDKL5缺乏症(CDD)相关的癫痫发作,这是一种罕见的遗传性癫痫。
当一种医药产品预计具有重大公共卫生利益和治疗创新时,CHMP将授予加速评估。一旦提交并验证营销授权申请(MAA),加速评估可能会将审查时间从210天缩短到150天。
8月初,Marinus向美国食品和药物管理局(FDA)提交了一份新药申请(NDA),申请使用ganaxolone治疗与CDD相关的癫痫发作。Marinus已请求FDA进行优先审查。FDA将在2021年第三季度结束前发出NDA备案通知函。
CDKL5缺乏症(CDD)是一种严重而罕见的遗传性疾病,由位于X染色体上的细胞周期蛋白依赖性激酶样5(CDKL5)基因突变引起。CDD的特点是发病早,癫痫发作难以控制,神经发育严重受损。目前,尚无专门针对CDD批准的治疗方法。
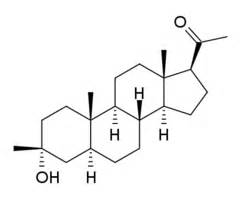
ganaxolone化学结构式(图片来源:Wikipedia.org)
ganaxolone是GABAA受体的一种阳性变构调节剂,目前正在开发静脉和口服制剂,旨在最大限度地扩大急性和慢性护理环境下成人和儿童患者群体的治疗范围。ganaxolone通过对突触和突触外GABAA受体的作用,发挥出抗癫痫和抗焦虑活性。在长达2年多的时间里,ganaxolone已对1800多名儿童和成人受试者中进行了各种不同适应症、治疗相关剂量水平和治疗方案的研究。
ganaxolone治疗CDD相关癫痫发作的营销授权申请(MAA),将由3期Marigold试验的数据支持。这是一项双盲安慰剂对照试验,在101名患者中开展。试验中,ganaxolone治疗组患者在28天中主要运动性发作频率的中位数减少了30.7%,而安慰剂组患者减少了6.9%,达到了试验的主要终点(p=0.0036)。在Marigold开放标签扩展研究中,接受ganaxolone治疗至少12个月的患者(n=48)主要运动性癫痫发作频率中位数减少49.6%。在这项3期试验中,ganaxolone的耐受性总体良好,安全性与先前的临床试验一致,最常见的不良事件是嗜睡。
Marinus高级副总裁、监管事务主管Kimberly McCormick表示:“我们认为,EMA的加速评估强调了ganaxolone在解决CDD患者和家庭未满足医疗需求方面的潜力。我们计划在第三季度末提交营销授权申请(MAA),并期待在EMA审查申请期间与EMA合作。如果获得批准,我们与Orion公司的合作将支持我们尽快将ganaxolone推向欧洲市场,使CDD患者受益。”
原文出处:European Medicines Agency Grants Marinus Pharmaceuticals Accelerated Assessment of Ganaxolone for Treatment of CDKL5 Deficiency Disorder
版权声明:本网站所有注明“来源:罕见病信息网”的文字、图片和音视频资料,版权均属于罕见病信息网网站所有。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。