研发企业uniQure于11月3日宣布,其 9 月公布的被称为 “突破性” 的研究数据 —— 显示基因治疗候选药物 AMT-130 能显著减缓亨廷顿舞蹈症(HD)患者的病情进展 —— 可能不足以获得 FDA 批准。这使得原本计划2026年一季度提交的生物制品许可申请(BLA)陷入不确定性。
该公司在声明中表示,基于近期与 FDA 官员举行的生物制品许可申请前(pre-BLA)会议,公司 “认为 FDA 目前已不再认可” AMT-130 的 I/II 期研究数据可作为支持 BLA 提交的主要证据。
福泰制药进一步指出,这一态度转变推翻了 FDA 此前的指导意见 —— 此前 FDA 支持公司将 I/II 期研究数据与外部对照数据进行对比分析,该指导意见已体现在公司开展分析前与 FDA 共享的预设试验方案和统计分析计划中。
“这与过去一年多次 B 类会议中 FDA 的沟通内容出现重大转变,” 福泰制药愤怒表示,“因此,AMT-130 的 BLA 提交时间目前尚不明确。”
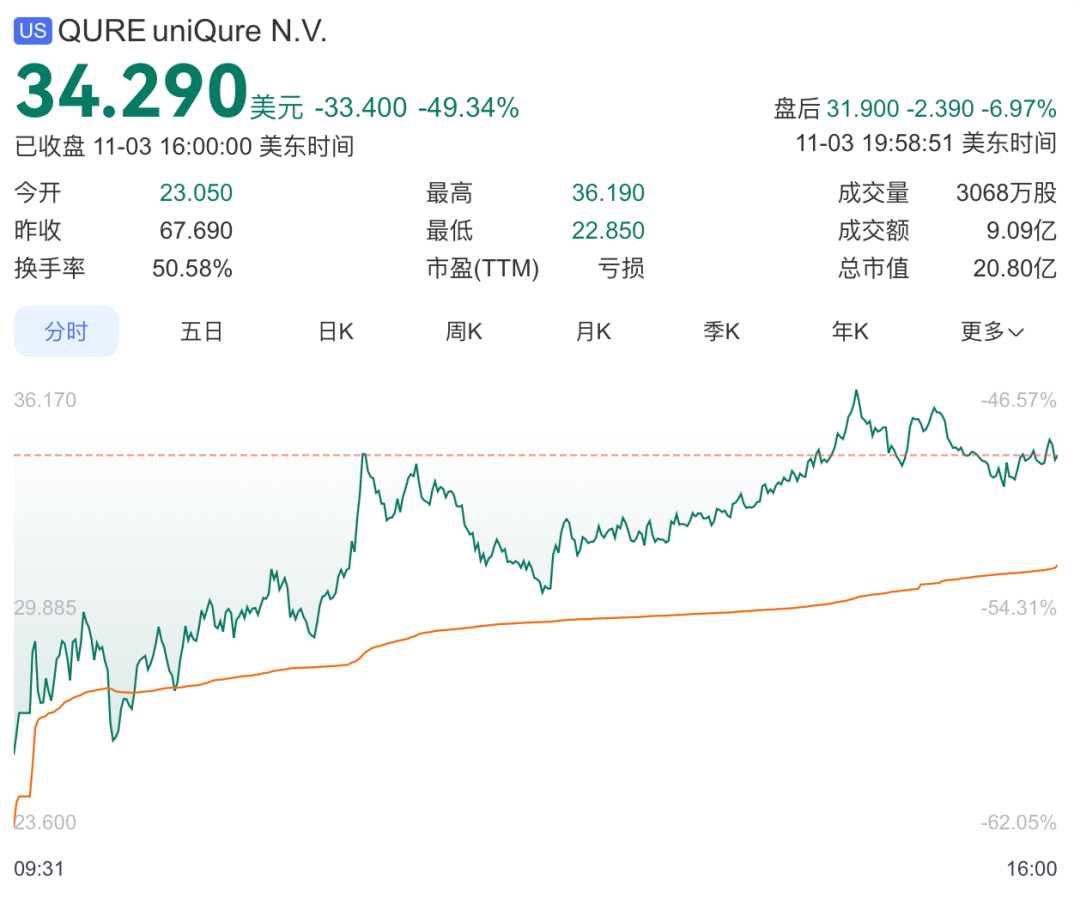
这一消息引发市场强烈反应,今日开盘后福泰制药股价随即暴跌 62%,从上周五收盘价 67.69 美元跌至 25.69 美元。数分钟后股价开始反弹,截至下午 3 点 08 分报 35.18 美元,当日累计跌幅收窄至 48%。
| 持续动荡
Leerink Partners 罕见病领域高级董事总经理兼高级研究分析师约瑟夫・P・施瓦茨(Joseph P. Schwartz)表示,FDA 的态度转变让人联想到该机构 7 月向 Replimune 公司发出完整回应函一事 —— 当时 Replimune 提交了核心候选药物 RP1(vusolimogene oderparepvec)联合纳武利尤单抗(百时美施贵宝旗下商品名 Opdivo®)用于治疗晚期黑色素瘤的生物制品许可申请(BLA)。
Replimune 公司 7 月透露,FDA 给出的理由包括单臂 II 期 IGNYTE 试验(NCT03767348)中患者群体存在异质性,以及由此导致的 IGNYTE 试验数据不充分、III 期 IGNYTE-3 试验(NCT06264180)研究设计中 “各组分的作用” 不明确。FDA 允许 Replimune 重新提交 BLA,并按加速审批通道受理了该申请,《处方药使用者付费法案》(PDUFA)目标决策日期定为 2026 年 4 月 10 日。
“结合近期 FDA 报道的其他变故,” 施瓦茨接着说,“我们希望这只是 FDA 内部持续动荡的一个缩影,就像 Replimune 的情况一样,最终仅导致延迟而非否决。”
施瓦茨提到,药物评价与研究中心(CDER)主任乔治・蒂德马什(George Tidmarsh)医学博士、哲学博士于昨日辞职。此前,蒂德马什因个人行为问题于上周五被行政休假,而休假的起因是投资者凯文・唐(Kevin Tang)向 FDA 提交了投诉 —— 蒂德马什 9 月曾在领英上发布帖子公开批评唐旗下奥里尼亚制药公司(Aurinia Pharmaceuticals)获批上市的狼疮性肾炎药物卢普替尼(Lupkynis®,活性成分为伏氯唑啉),该帖子现已删除。帖子中呼吁 FDA 重新审查基于替代终点获批的药物(如卢普替尼)。
福泰制药(uniQure)补充称,预计将在 30 天内收到 pre-BLA 会议的最终纪要。公司表示,此后 “计划与 FDA 进行紧急沟通,为 AMT-130 及时通过加速审批找到前进路径”。同时,公司还计划推进与美国以外监管机构的讨论,包括欧盟和英国的监管机构。
| 计划开展 “紧急” 沟通
福泰制药此前曾宣布,计划于 2026 年第一季度向 FDA 提交 AMT-130 的 BLA,并预计同年晚些时候在美国上市。
这些乐观计划的背后,是该公司此前公布的 AMT-130 治疗亨廷顿舞蹈症(HD)的阳性数据。其中关键结果包括:高剂量组(6×10¹³ 基因组拷贝 / 受试者)患者经复合统一亨廷顿舞蹈症评定量表(cUHDRS)评估,病情进展显著减缓 75%,达到研究主要终点,且具有统计学意义。
“病情进展减缓 75%,这一结果甚至超出了我们的预期、期待和希望,” 伦敦大学学院(UCL)亨廷顿舞蹈症中心主任萨拉・塔布里齐(Sarah Tabrizi)医学博士、哲学博士在福泰制药为讨论该数据召开的电话会议上向分析师表示。
这项 I/II 期研究包含美国(NCT04120493)和欧洲(NCT05243017)的试验,高剂量组患者 36 个月的其他主要阳性疗效结果包括:
经总功能评分(TFC)评估,病情进展减缓 60%,达到研究关键次要终点,且具有统计学意义;
各次要终点均观察到病情进展减缓,其中总运动评分(TMS)显示减缓 59%、符号数字模式测试(SDMT)显示减缓 88%、斯特鲁普单词阅读测试(SWRT)显示减缓 113%。
| 股价暴跌66%
9 月公布的超预期阳性数据推动福泰制药股价暴涨 248%,从 13.66 美元升至 47.50 美元,涨幅超两倍,创下五年新高。次日股价再涨 11% 至 52.65 美元,9 月 26 日又上涨 3%,当周收于 54.31 美元。
然而,福泰制药今日特别指出,基于 I/II 期研究与外部对照的数据对比,FDA 已于 4 月授予 AMT-130 突破性疗法认定,并于 2024 年 5 月授予再生医学先进疗法(RMAT)认定。受此消息影响,uniQure股价在11月3日盘前交易中暴跌66%。
“我们对 FDA 在近期 pre-BLA 会议上的反馈感到惊讶,这与 FDA 2024 年 11 月给出的指导意见大相径庭 —— 当时 FDA 表示,正在进行的 I/II 期研究数据与自然病史外部对照的对比结果,可作为通过加速审批通道提交 BLA 的主要依据,” 福泰制药首席执行官马特・卡普斯塔(Matt Kapusta)在声明中表示,“这一消息令人意外,我们为亨廷顿舞蹈症患者深感失望,他们目前尚无针对这种毁灭性疾病的疾病修饰治疗选择。”
“我们坚信 AMT-130 有潜力为患者带来显著获益,并将继续全力与 FDA 合作,找到最佳路径,尽快将 AMT-130 带给美国的患者及其家属,” 卡普斯塔承诺道。