2025年7月12-13日,蔻德罕见病中心与瑞鸥公益基金会在杭州联合主办患者社群推动药物研发赋能会暨全国罕见病患者组织网络年会。
会议以 “患者社群推动自救式药物研发” 为核心,形式与内容有新突破。围绕药物研发全流程设四大主题分享,邀多领域专家参与,通过四个工作坊促进患者与专家深度交流,旨在解决各阶段核心问题,沉淀经验、形成共识、助力行动。
此次赋能会吸引66个疾病的120位代表,含39个患者组织代表。会上特设 “微光博物馆”,参会者的信物成为情感桥梁与对话媒介,传递个体故事的温度与力量。
蔻德罕见病中心将通过连载发布本次赋能会的相关内容,本篇为系列内容6,您可通过文尾[相关阅读]了解本系列全部内容。
赵太云
《罕见病药物非临床安全性与有效性研究策略分享》

广西生物活性分子研究与评价重点实验室副研究员、瑞鸥公益基金会技术顾问赵太云博士分享主题为《罕见病药物非临床安全性与有效性研究策略分享》。
药物是指查明或者改善机体生理功能或状态,对用药者有好处,达到预防、诊断、治疗疾病和计划生育目的的物质。包括中药、中药饮片、中成药、化学药、制剂、抗生素、生物化制品、放射性物品、血清、疫苗、血液制品和诊断用品等,毒物就是对机体产生毒害作用、损害机体健康的物质,但是药物和毒物不是绝对的概念。药品是一个商品属性,规定适应症,规定剂型用法用量。药物研究是多学科融合在一起的复杂系统性工程,概念多,学科多,涉及的基本知识多。
罕见病药物研发是科学研究药物开发里面非常重要的一个领域,没有成熟的模型、检测指标和生物标志物,因此从某种程度上来讲,罕见病药物开发的复杂度比常见病要难,在开发过程的科学性也很难。
多学科组成了药物研究重要的基础,包括药学、药代、药效、毒理等。药学是基础,药效评价是前提,毒理是核心,临床评价是关键。
整个药物研发的周期很长,包括基础研究和工程化开发。赵老师通过介绍“反应停”事件,提示了药物临床前动物实验对于药物研究的重要性,“反应停”事件是人类历史上做药物研发从简单的药物开发流程向严监管过程中一个里程碑性的事件。
药物临床前要做到有效性、安全性,为临床的安全用药起始剂量等提供数据支撑,这就是临床前做药效学研究和安全性研究的一个重要作用。临床前的药效要回答的问题很多,包含不同的系统模型中验证有效性,表征药物的量效、时效关系,给药方案,探明作用机制,为进入临床有效提供方案,提供数据支撑,为毒理研究动物或剂量提供指标依据。毒理学研究主要回答的是安全性问题,动物模型的毒理学研究为人类的安全用药提供一个安全保障。
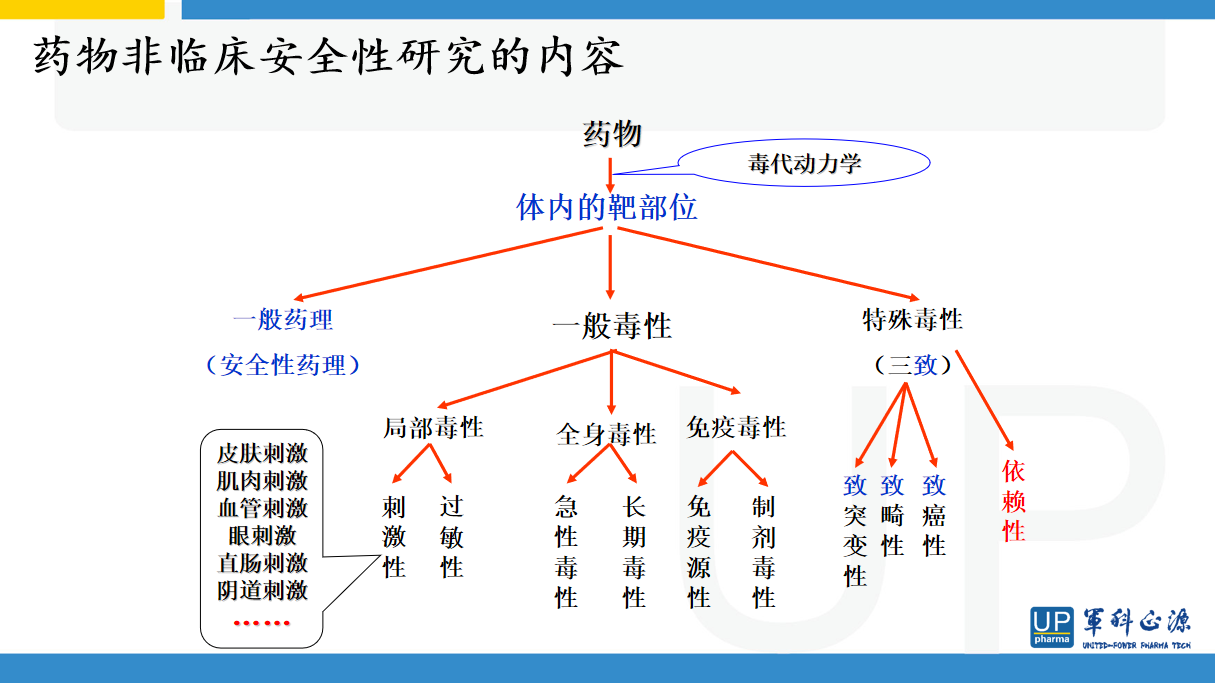
目前非临床有效性临床研究中仍然有很多问题。首先受试药物不能代表临床样品,第二动物实验具有局限性,人和动物差异太大,临床疾病与动物模型的差异也很明显。毒理方面也存在很大的差异,人和动物对药物毒副反应存在重大差异,动物数量和发生毒性有时候难以发现;临床病人可能对某种药物非常敏感,出现特异性反应,毒理实验所用的大多数动物都是健康的,而临床研究很多情况下是处于病理状态或者亚健康状态的用药。还有动物实验中往往采用大剂量的做法,与临床相差比较远,有时候造成一种假象。为此赵老师举了大量的例子。
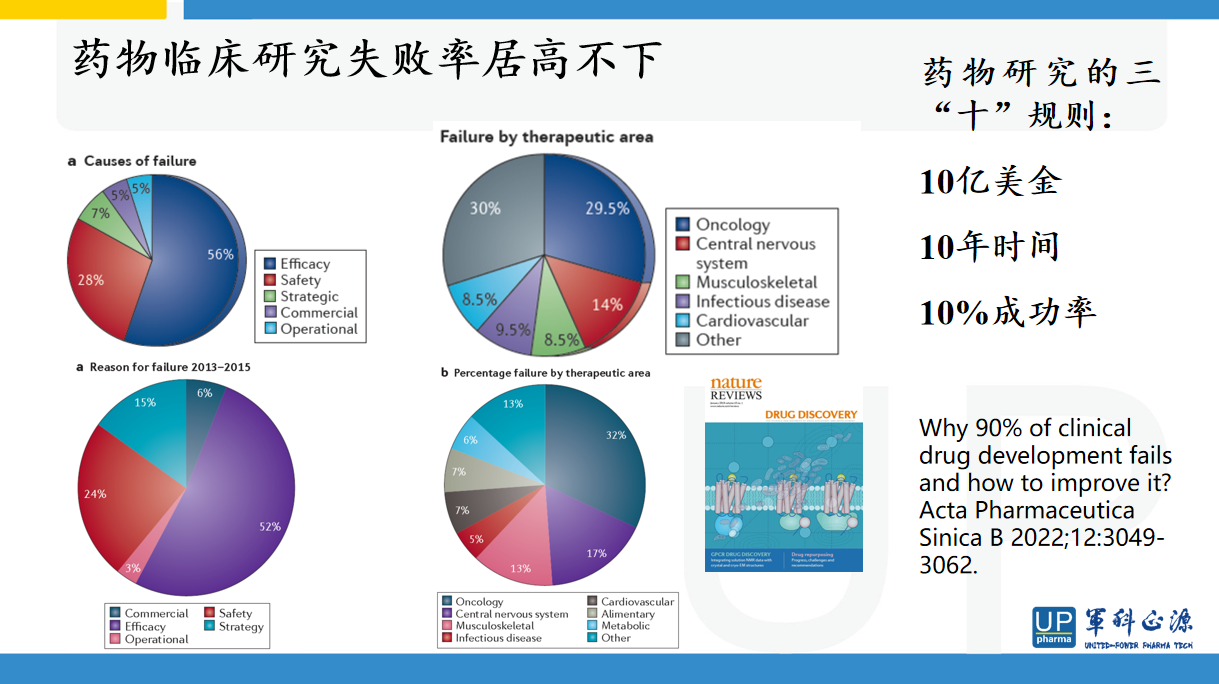
赵老师介绍了非临床做动物实验的原因,动物实验的内容和目的,以及动物实验的局限性。药物研发是一个高风险高投入高回报的领域,人类对生命规律的认知非常有限,目前仍然是冰山一角,今天对生命科学的判断和发现仍然处于盲人摸象阶段,现在研究在将来有可能被证明是错误的或者是不准确的。需要大量的研究才有可能站在全局的角度来看待复杂的生命体。
蔻德罕见病中心&瑞鸥公益基金会将持续关注和参与推动罕见病患者社群推动药物研发这一议题的工作。如您对这一议题有兴趣,希望参与交流、进行项目合作、提供其他支持等,都可以与我们取得联系,请您留下基础信息,我们会及时与您取得联系,共同为罕见病患者社群早日实现有药可医而努力!
