2025年10 月 14 日, Rocket Pharmaceuticals传来重磅消息 —— FDA正式接受其旗下基因疗法 KRESLADI™(marnetegragene autotemcel,简称 marne-cel)的生物制品许可申请(BLA)重新提交。这款针对严重白细胞黏附缺陷症 - I 型(LAD-I)的实验性疗法,FDA设定的 PDUFA日期为2026年3月28日。若顺利获批,或将为面临 “童年致死” 风险的 LAD-I 患儿带来 “一次性治愈” 的希望。
一旦 ITGB2 基因突变,CD18 蛋白功能缺失,LAD-I 患儿的免疫系统就成了 “没牙的老虎”:从婴儿期开始,他们会反复遭遇危及生命的细菌、真菌感染,对常规抗菌药物反应极差,不得不频繁住院;还会出现难以愈合的皮肤损伤、严重牙周炎等慢性炎症。约 61%-69% 的患儿属于 “严重型”,若不接受移植手术,60%-75% 的患者会在 2 岁前夭折,能活过童年的病例寥寥无几。骨髓移植是唯一选择,但缺陷明显,且可能无法及时为儿童提供。

KRESLADI™的设计思路直击疾病根源 —— 通过 “自体造血干细胞 + 慢病毒载体” 的基因治疗方案,为患儿补上 “缺失的正常基因”。
其具体原理并不复杂:先从患者自身提取造血干细胞,再用经过安全改造的慢病毒载体,将功能性的 ITGB2 基因 “递送到” 干细胞中;这些修复后的干细胞回输到患者体内后,就能持续产生正常的 CD18 蛋白,让白细胞恢复 “粘附 - 抗感染” 的核心功能。
这种 “一次性修复” 的思路,也得到了监管机构的认可。在美国,KRESLADI™已获得 FDA 授予的 “再生医学先进疗法(RMAT)”“罕见儿科疾病”“快速通道” 认证;在欧盟,它同样拿下 “PRIME ” 和 “先进疗法药物(ATMP)” 资格,且在欧美两地均被认定为 “孤儿药”—— 这些认证不仅意味着监管层面的重视,也加速了药物的研发与审评进程。
此次 BLA 重新提交能被 FDA 受理,核心支撑是 KRESLADI™全球 1/2 期临床试验的 “硬核数据”—— 在所有入组的严重 LAD-I 患者中,输注后 12 个月及整个随访期间的总体生存率达到 100%,且所有预设的主要、次要临床终点均全部达成。
试验中没有出现任何与 KRESLADI™治疗相关的严重不良事件,证明这款疗法的耐受性良好。与此同时,患者的临床症状也得到显著改善:与治疗前相比,严重感染的发生率大幅下降,长期不愈的皮肤损伤逐渐好转,甚至连创伤愈合能力也恢复到了接近正常水平。
值得一提的是,若 KRESLADI™最终获得 FDA 批准,Rocket Pharmaceuticals 还将有资格获得 “罕见儿科疾病优先审评券(PRV)”。这种审评券是 FDA 为鼓励罕见病药物研发推出的激励工具,持有者可在未来申请其他药物时,享受优先审评的资格,其行业价值与战略意义不言而喻。
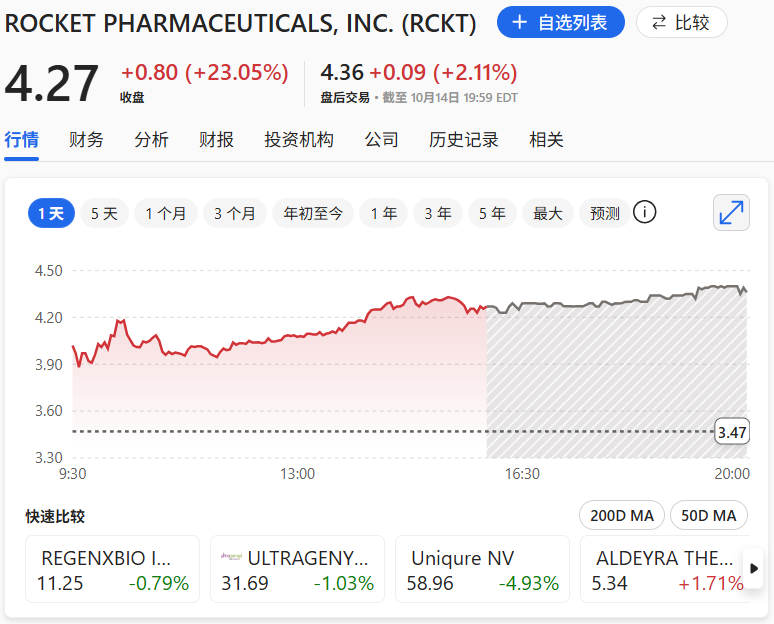
受此消息影响,公司股价大涨23%。