近日,美国盖伦基金会(The Galien Foundation)宣布了2024年度盖伦奖(Prix Galien USA Awards)的候选名单。被誉为“医药界的诺贝尔奖”的盖伦奖被公认为是医药和生物医疗行业的最高荣誉,以表彰在生物技术产品、药品以及罕见/孤儿病产品领域的创新成就,所提名的候选药物必须在过去五年内获得美国食品和药物管理局 (FDA) 的上市批准,并表现出改善人类健康的巨大潜力。提名委员会在评选奖项提名时不考虑销售数据,只考虑科学和健康影响。
八款罕见病产品/疗法入围最佳罕见/孤儿病产品提名。其中,有一款罕见病新药在今年7月获得中国国家药品监督管理局(NMPA)批准上市。
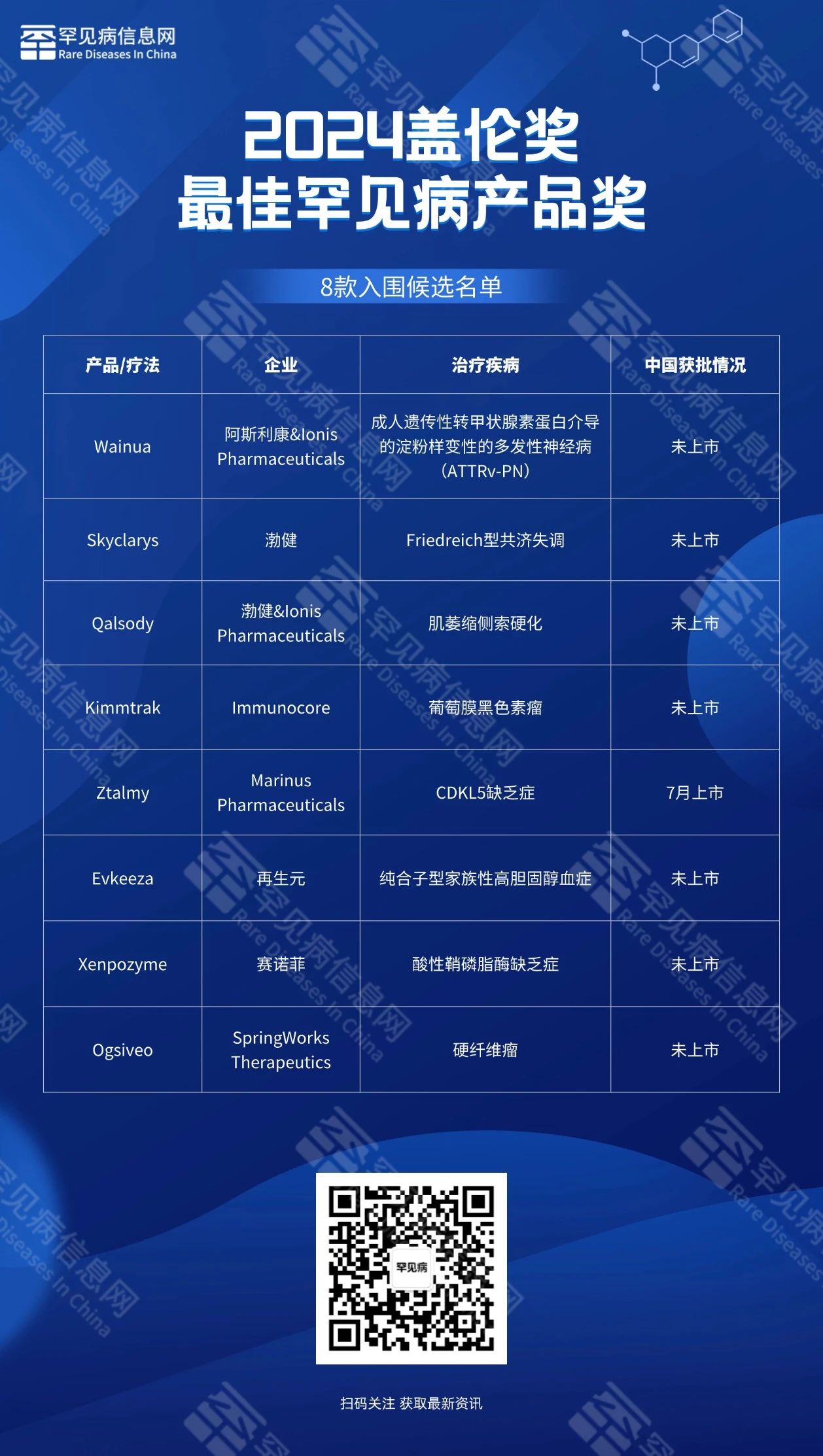
阿斯利康&Ionis Pharmaceuticals:Wainua
2023年12月,由阿斯利康(AstraZeneca)和Ionis Pharmaceuticals联合开发的每月一次、可由患者自己皮下注射的反义寡核苷酸(ASO)疗法Wainua(Eplontersen)获FDA批准上市,用于治疗成人遗传性转甲状腺素蛋白(TTR)介导的淀粉样变性的多发性神经病(ATTRv-PN)。Wainua是首个可通过自动注射器自行给药用于治疗ATTRv-PN的获批药物。
遗传性甲状腺素转运蛋白介导的淀粉样多发性神经病(hATTR-PN)是一种罕见的遗传性疾病,是由转甲状腺素蛋白(transthyretin,TTR)错误折叠导致其在组织中异常沉积所致的系统性疾病,患者会经历全身神经持续衰弱损伤,导致运动功能渐进性丧失,如行走。这些患者还在其他主要器官中积累TTR,逐渐损害其功能。
渤健:Skyclarys
2023年3月,FDA批准了Nrf2激动剂Skyclarys(Omaveloxolone)的新药申请(NDA),用于治疗16岁以上弗里德赖希共济失调症(Friedreich’s Ataxia,FA)患者。这是FDA批准的首款针对弗里德赖希共济失调症的药物。Omaveloxolone曾在2021年11月获得FDA授予的快速通道资格,并在2022年5月获得罕见儿科疾病认定。
弗里德赖希共济失调症是表现小脑性共济失调的最常特发性变性疾病。为常染色体隐性遗传,人群患病率2/10万,近亲结婚发病率高达5.6%-28%。本病具有独特的临床特征,如儿童期发病,肢体进行性共济失调,伴锥体束征、发音困难、深感觉异常、脊柱侧突、弓形足和心脏损害等。
渤健&Ionis Pharmaceuticals:Qalsody
2023年4月,FDA宣布加速批准反义寡核苷酸(ASO)疗法Qalsody(Tofersen)上市,用于治疗具有超氧化物歧化酶1突变的肌萎缩侧索硬化(SOD1-ALS)。这是FDA批准治疗遗传性ALS的首款疗法。这也是首款基于生物标志物加速批准的ALS疗法。这一批准不但为具有SOD1突变的ALS患者带来了具有针对性的疗法,对基于生物标志物加速神经退行性疾病的疗法开发也具有重要意义。
ALS是一种进行性神经退行性疾病,影响大脑和脊髓中的神经细胞,也被称为“渐冻症”。患者大脑和脊柱的运动神经元会不断死亡,导致肌肉无力和瘫痪,从无法行走到无法说话、吞咽、呼吸。ALS患者在确诊后平均寿命小于5年。许多基因被认为与此疾病有关,其中SOD1-ALS患者约占了2%。
Immunocore:Kimmtrak
2022年1月,美国FDA批准Immunocore创新疗法Kimmtrak(Tebentafusp-tebn)上市,治疗特定的葡萄膜黑色素瘤。值得一提的是,Kimmtrak的批准创造了许多个第一:(1)第一个获得FDA监管批准的TCR疗法;(2)第一个获得FDA监管批准治疗实体瘤的双特异性T细胞接合器;(3)第一个也是唯一一个获得FDA批准治疗不可切除性或转移性mUM的疗法。
作为一款创新的双特异性蛋白,Kimmtrak由两部分融合而成:一端是具有高亲和力的可溶性T细胞受体,另一端是抗CD3的免疫效应结构域。这款疗法能特异性地靶向gp100,一种在黑色素细胞和黑色素瘤中表达的抗原。先前,这款“first-in-class”疗法已获得美国FDA的突破性疗法认定、快速通道资格、孤儿药资格、以及优先审评资格。
葡萄膜黑色素瘤(UM)是严重危害患者生命及视功能的成人最常见的眼内原发性恶性肿瘤,其占所有眼部黑色素瘤的 85%,超过 50% 的葡萄膜黑色素的患者会发生全身转移性。最常转移的部位是肝脏,患有该种疾病的患者中,很少能通过手术来达到好的治愈效果,因此也导致该疾病预后不良。
Marinus Pharmaceuticals:Ztalmy(加那索龙)
2022年3月,美国FDA已批准Ztalmy(Ganaxolone)口服混悬剂上市,在两岁以上的患者中,用于治疗与细胞周期蛋白依赖性激酶样5(CDKL5)缺乏症(CDD)相关的癫痫发作。这是一种罕见的遗传性癫痫。这是首款获得FDA批准针对这一患者群体的疗法。Ztalmy是一款神经活性类固醇,可作为GABAA受体的阳性别构调节剂。7月16日,元羿生物授权引进并商业化的泽元安®加那索龙口服混悬剂,已在中国获得NMPA批准正式上市。
CDKL5缺乏症(CDKL5 deficiency disorder,CDD)是由位于X染色体的CDKL5基因功能缺失性突变导致的神经发育疾病,主要症状包括早发性癫痫、刻板动作以及认知与运动障碍等,此前尚无获批疗法。
再生元:Evkeeza
2021年2月,再生元(Regeneron)公司开发的“first-in-class”降脂疗法Evkeeza(Evinacumab-dgnb)获得美国FDA批准,用于和其它降低低密度脂蛋白胆固醇(LDL-C)的疗法联用,治疗12岁以上纯合子家族性高胆固醇血症(HoFH)患者。Evkeeza是FDA批准的第一款结合并阻断血管生成素样蛋白3(ANGPTL3)功能的靶向疗法。
纯合子型家族性高胆固醇血症(HoFH)是一种罕见的常染色体显性遗传疾病,以低密度脂蛋白胆固醇(LDL-C)水平显著升高和早发动脉粥样硬化性心血管疾病为主要特征。
赛诺菲:Xenpozyme
2022年9月,美国FDA宣布批准赛诺菲(Sanofi)旗下Genzyme公司的创新酶替代疗法Xenpozyme(Olipudase alfa)上市,用于静脉输注治疗酸性鞘磷脂酶缺乏症(acid sphingomyelinase deficiency,ASMD)的成人和儿童患者。此药品为FDA批准的首款用于ASMD患者非中枢神经系统症状的药物。
酸性鞘磷脂酶缺乏症(Acid sphingomyelinase deficiency,ASMD)是一种常染色体隐性溶酶体贮积症,由编码溶酶体酶酸性鞘磷脂酶的SMPD1基因中的双等位基因致病变异体引起,使酶活性下降甚至缺失,从而导致鞘磷脂异常沉积的溶酶体内脂质贮积病,又称为尼曼匹克病。
SpringWorks Therapeutics:Ogsiveo
2023年11月,美国FDA宣布批准Ogsiveo(Nirogacestat)片剂用于需要全身治疗的进展性硬纤维瘤成人患者。Ogsiveo是首个被批准用于治疗硬纤维瘤患者的药物。Nirogacestat是一款口服特异性γ-分泌酶(γ-secretase)小分子抑制剂。γ-分泌酶能够切割多种跨膜蛋白复合体,其中包括Notch蛋白。而Notch蛋白被认为能够激活导致硬纤维瘤生长的信号通路。Ogsiveo曾获得美国FDA授予快速通道资格、突破性疗法认定与优先审评资格,用以治疗进行性、不可切除复发或难治性硬纤维瘤或深部纤维瘤病成人患者。
硬纤维瘤(desmoid tumor,DT) ,亦称侵袭性纤维瘤病(aggressive fibromatosis)、韧带样纤维瘤病(desmoid type fibromatosis),是一种罕见的软组织肉瘤亚型。
去年,荣获该奖项的产品有勃林格殷格翰的圣利卓®(佩索利单抗)与杰特贝林的Hemgenix,分别用于治疗成人泛发性脓疱型银屑病与B型血友病。值得注意的是,圣利卓®(佩索利单抗)已经成功在中国获得了上市批准,为国内患者带来了新的治疗选择。