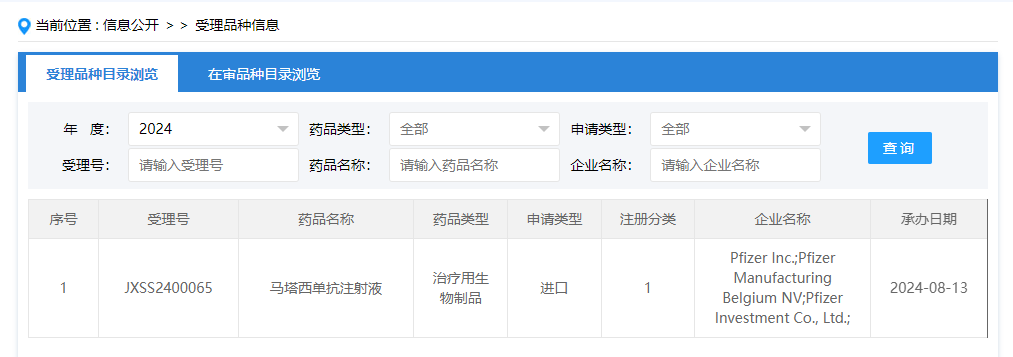
8月13日,中国国家药监局药品审评中心(CDE)官网公示,由辉瑞(Pfizer)申报的1类治疗用生物制品马塔西单抗注射液在中国申报上市并获得受理。马塔西单抗(marstacimab)是由辉瑞研发的一款新型血友病治疗药物,用于A型以及B型血友病。
Marstacimab是新型抗组织因子途径抑制剂(TFPI),其初始给药方案为每周一次300 mg固定剂量(非基于体重),随后每周一次150 mg 固定剂量。这一非因子疗法有望改变过去因子疗法一周多次、静脉输注给患者及其家人带来的心理负担和用药负担。
血友病是一种罕见的遗传性血液疾病,由凝血因子缺乏(A 型血友病是 FVIII,B 型血友病是 FIX)引起,导致血液无法正常凝结。
此前一项全球性多中心、开放标签的关键III期BASIS临床研究(NCT03938792)已达到主要终点。该研究共纳入约145例患有重度A型血友病(FVIII<1%)或中度至重度B型血友病(FIX≤2%)青少年和成人受试者,无论患者体内有没有生成抑制剂。
研究显示,marstacimab在降低年化出血率(ABR)方面具有显著的统计学意义和临床相关性。其中,相比常规预防治疗和按需治疗,marstacimab可使体内不伴抑制物的血友病A及血友病B患者的年化出血率分别降低35%和92%。同时,在该临床试验的长期扩展观察性研究中,患者在额外的16个月随访后,仍能观察到出血率持续下降。
目前,marstacimab在全球范围内均尚未获批上市,2023年12月,marstacimab的生物制剂许可申请(BLA)获得了FDA和EMA的受理。其中,FDA将PDUFA日期定在2024年Q4,EMA预计在2025年Q1做出审批决定。2024 年 2 月,该药也在日本提交了上市申请。
中国将与全球同步递交上市注册申请,争取成为第一批上市的国家之一,为中国患者带来最新的前沿突破疗法,满足疾病诊治未被满足的需求。