Citius Pharmaceuticals公司今天宣布,美国FDA已批准Lymphir(denileukin diftitox)上市,作为一种新型免疫疗法,治疗至少接受过一种全身治疗的复发/难治性皮肤T细胞淋巴瘤(r/r CTCL)患者。新闻稿指出,Lymphir是自2018年以来,FDA批准的首款治疗r/r CTCL的创新全身性靶向疗法。它也是首款靶向恶性T细胞和调节性T细胞(Tregs)上的白细胞介素-2(IL-2)受体的CTCL疗法。

Lymphir的批准是基于关键性3期试验302的结果,该研究包含至少接受过一种全身治疗的CTCL患者。实际招募的患者接受前期全身性抗癌治疗的治疗线数中位数为4。主要疗效人群包括69名I-III期CTCL患者,这些患者接受了Lymphir(9 μg/kg/天)治疗。主要疗效终点是由独立审查委员会(IRC)评估的客观缓解率(ORR)。
试验数据显示,Lymphir的ORR为36.2%(95% CI:25.0-48.7),其中8.7%的患者达到了完全缓解(CR),疾病控制率达到49%。患者对疗法迅速产生应答,大多数应答者(约70%)在1-2个治疗周期后看到效果。获得缓解的患者中52.0%的缓解持续时间至少为6个月。84.4%(54/64)的皮肤可评估受试者的皮肤肿瘤负担减少,12.5%(8/64)患者的皮肤病变完全清除。
安全性方面,在三项共119名接受9 μg剂量Lymphir的CTCL患者的研究中,最常见的(≥20%)不良反应分别是转氨酶升高,白蛋白减少,恶心,水肿,血红蛋白减少,疲劳,肌肉骨骼疼痛,皮疹,寒战,便秘,发热和毛细血管渗漏综合征(CLS)。
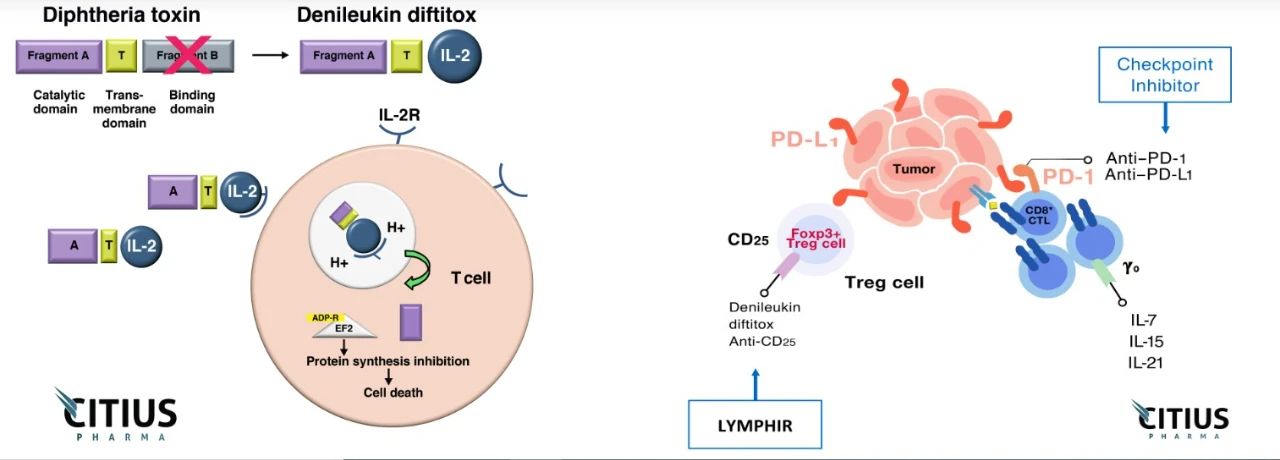
Lymphir是一款由IL-2和白喉毒素(diphtheria toxin)组合在一起的重组融合蛋白,它与细胞表面的IL-2受体相结合,导致白喉毒素片段进入细胞抑制蛋白合成。这一独特的作用机制让它可以同时靶向恶性T细胞和具有免疫抑制作用的调节性T细胞(Tregs)。暂时消灭Tregs具有增强患者免疫系统抗癌免疫反应的潜力。
在临床前研究中,Lymphir能够在小鼠肿瘤模型中清除Tregs,而且与抗PD-1抗体联用,在实体瘤模型中显著提高动物的生存时间。这款疗法最初由卫材(Eisai)公司开发,并在2021年在日本获批上市。Citius公司拥有在日本和部分亚洲国家和地区以外全球其他地区开发和商业化Lymphir的权益。
目前,Lymphir还在两项研究者启动的研究中接受检验,分别为与PD-1抑制剂Keytruda联用,治疗实体瘤患者,以及在复发/难治性B细胞血液癌症患者接受淋巴细胞清除化疗和CAR-T疗法之前使用,增强对Tregs的清除。这些研究的结果可能进一步扩展Lymphir的应用范围。
CTCL是一种罕见且常使人衰弱的慢性非霍奇金淋巴瘤,主要影响皮肤。复发/难治性CTCL患者的治疗选择有限,此前没有统一的单一治疗方法可以用于治疗这些无法治愈的癌症患者。