7月24日,武田与信念医药共同宣布:国家药品监督管理局(NMPA)已正式受理BBM-H901注射液用于治疗血友病B成年患者的新药上市申请(NDA)。
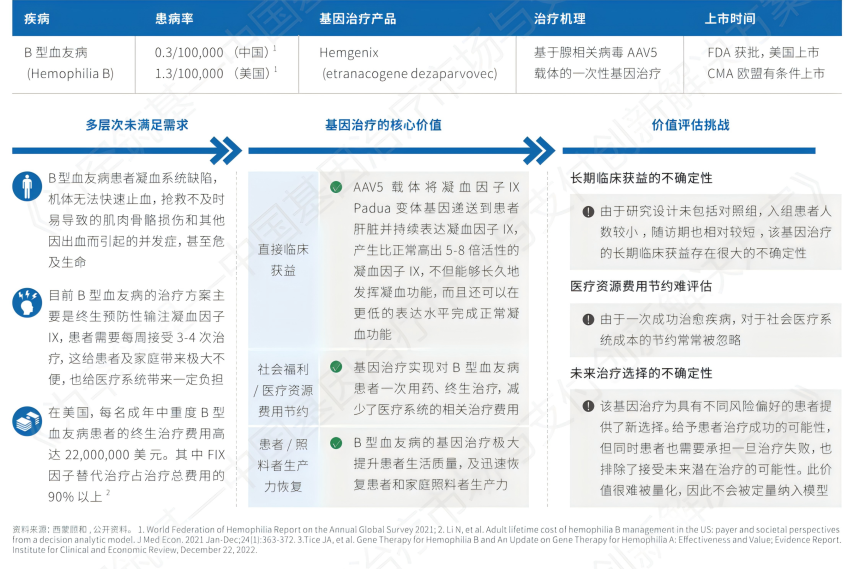
血友病通常分为血友病A和血友病B,分别是由于缺乏凝血因子Ⅷ和凝血因子Ⅸ引起的。B型血友病是一种罕见的遗传性凝血障碍,由于血液中缺乏或没有正常工作的凝血因子IX引起。B型血友病患者凝血系统缺陷,机体无法快速止血,抢救不及时易导致的肌肉骨骼损伤和其他因出血而引起的并发症,甚至危及生命。由于B型血友病是严重的终身疾病,目前的治疗方案主要是终生预防性输注凝血因子IX,患者需要每周接受3-4次治疗,这给患者及家庭带来极大不便。在美国,每名成年中重度B型血友病患者的终身治疗费用高达$22,000,000。其中FIX 因子替代治疗占治疗总费用的 90% 以上。
BBM-H901注射液是信念医药自主研发和生产的首款重磅产品,也是国内首个递交新药上市申请的针对遗传病的基因治疗药物。2023年,武田中国宣布与信念医药达成血友病B领域独家商业化合作协议,未来将由武田中国负责该产品在中国内地、中国香港和中国澳门的商业化推广工作。
新闻稿指出,此次里程碑式进展,意味着该款产品有望成为中国首个获批上市的适用于血友病B的重组腺相关病毒(AAV)的基因疗法,亦有望重塑全球AAV基因治疗领域新格局。
本次研究(CTR20212816)是一项多中心、单臂、开放、单次给药注册临床研究,旨在评估单次静脉输注BBM-H901注射液在≥18岁且内源性凝血因子Ⅸ(FⅨ)活性≤2 IU/dL(即≤2%)的血友病B患者中的安全性和有效性。截至目前,其III期确证性研究阶段的所有受试者均已完成给药后52周访视,该注册研究的安全性和有效性均达到预期。
BBM-H901注射液由信念医药自主研发和生产,以静脉给药的方式将人凝血因子IX基因导入血友病B患者体内持续表达,提高并长期维持患者的凝血因子水平,用于预防血友病B成年患者出血。2022年,BBM-H901注射液被国家药监局药品审评中心纳入“突破性治疗品种”名单。2024年,该款产品成为国内首个递交新药上市申请的AAV基因治疗药物。其研究者发起的临床研究(IIT)的研究结果先后发表于国际权威期刊《柳叶刀-血液病学》和《新英格兰医学杂志》,并在2024国际血栓与止血学会(ISTH)大会上以口头报告形式展示。
针对血友病B,全球首款基因疗法是CSL/UniQure的Hemgenix。2022年在美国获得FDA的批准上市,截至 2023 年 6 月, Hemgenix 的营收接近 12 亿美元;同年 12 月底,收入增加 6.62 亿美元。
Hemgenix (etranacogene dezaparvovec)是基于AAV-5载体的一次性基因治疗。Hemgenix将凝血因子IX Padua变体基因递送到患者肝脏并持续表达凝血因子 IX,产生比正常高出 5-8 倍活性的凝血因子 IX,不但能够长久的发挥凝血功能,而且还可以在更低的表达水平完成正常凝血功能。与基因治疗前使用预防性凝血因子治疗的出血率相比,接受Hemgenix治疗的患者关节出血减少了80%,其他部位的出血也有类似的减少。
图:治疗B型血友病的Hemgenix在美国的价值评估
图源《为罕筑基—中国基因治疗市场与支付创新解决方案》
第二款获批上市的基因疗法是辉瑞公司的Beqvez,今年1月份,加拿大卫生部(Health Canada)批准该疗法上市。次年4月,该药物获得美国FDA批准。Hemgenix和Beqvez在美国的定价均为350万美元。
BBM-H901如果顺利获批,将成为国内首款首款基因治疗药物。