《患者参与药物监管决策的路径研究》
在2024国际罕见病日中国区宣传周期间,由蔻德罕见病中心联合中国药科大学国际医药商学院茅宁莹教授团队开展的《患者参与药物监管决策的路径研究》报告重磅发布!报告旨在摸清目前各方对患者参与的认知及需求,让患者参与药物监管的路径和模式更加明晰,并建立良好的、规范化的患者参与机制,提升患者在药物监管过程中的参与广度与深度。
“罕见病信息网”将独家展开全文连载,敬请读者关注和转发。本文为连载第七篇:《患者参与药物监管的国际经验:欧盟患者参与药物监管体系建设》。
第一篇:《患者参与药物监管的相关概念界》
第二篇:《患者参与药物监管的动力》
第三篇:《企业及其他相关方对患者参与药物监管有哪些需求?》
第四篇:《患者参与药物监管的理论基础》
第五篇:《WHO患者参与药物监管的经验》
第六篇:《美国患者参与药物监管体系建设》
欧盟患者参与药物监管体系建设
概念界定与评估标准
PART/1 患者与患者组织定义
EMA依赖于由组织或个人组成的广泛的欧洲患者和消费者网络,其中:
个人患者或护理者(Individual patients or carers):个体患者是指有患病经历的人。护理员是指支持个别病人的人,如家庭成员,以及有偿或志愿服务人员。他们可能有(也可能没有)研发或监管流程方面的技术知识,但他们的主要作用是贡献自己的主观疾病和治疗经验。
患者组织(Patients organizations)被定义为以患者为中心的非营利组织,患者和/或护理者(当患者无法代表自己时)在管理机构中代表大多数成员。这些组织可以是:
一般的伞式组织(例如,代表欧洲特定疾病的组织和/或国家伞式组织);
欧洲特定疾病组织(即代表国家组织或急性和/或慢性疾病的组织)。
PART/2 患者组织需要满足的标准
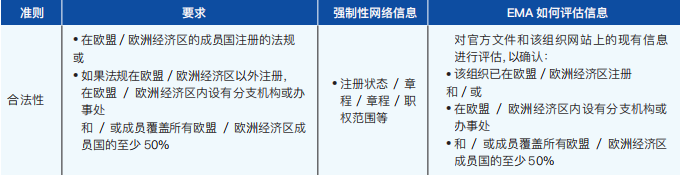
(1)预评估
当一个新的组织申请资格时,要进行预评估,以确认该组织具有非营利性地位,并符合为患者、消费者或医疗专业组织所规定的定义(如图3-4):

图3-4 患者组织参与预评估需满足的条件
如果这些条件得到满足,将进行全面的评估,如下文所述:
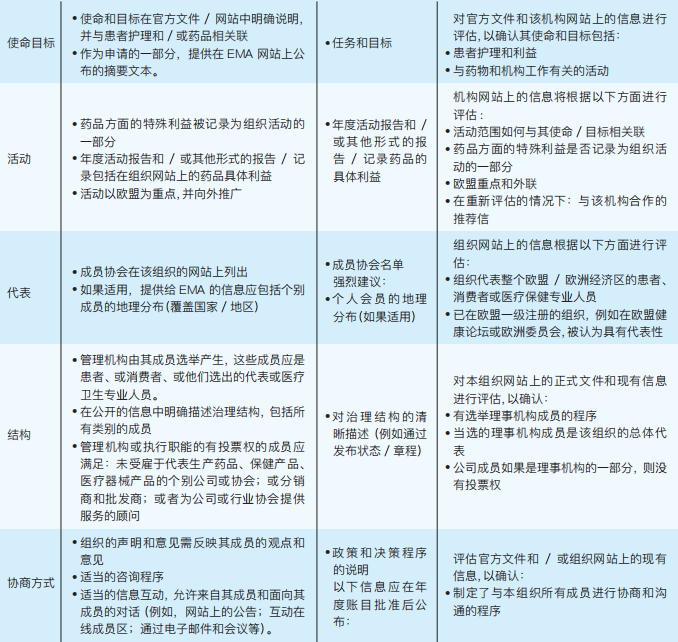
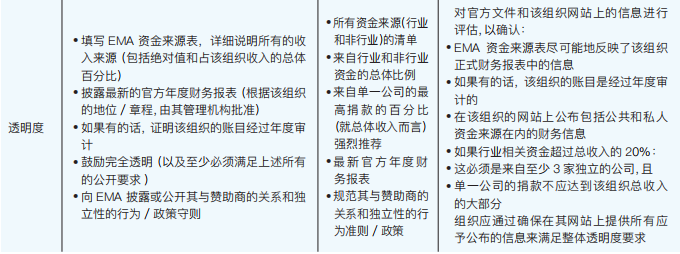
(2)满足标准
下表概述了如何评估每个标准的合规性(如表3-4):
表3-4 EMA如何评估每个标准的合规性
(3)每年对资格进行重新评估
每个符合条件的组织每年需要进行一次“自我资格声明”,以确认他们仍然符合标准。这些组织需要完成并提交一份电子表格(表格会通过利益相关者数据库自动发给他们),随后这些组织需要确认是否符合7项资格标准中的每一项(一系列的勾选框)与资金方面的要求。一旦提交,EMA将进入验证阶段,如果该组织同样地符合所有标准,他们将收到合规确认书,该组织将继续成为EMA网站上所列的EMA合格组织的一部分。
评估过程为:通过EMA网站进行公开征集申请;由EMA内部的评估委员会进行评估,确定申请人是否符合资格标准;在EMA官网上公布符合条件的患者和消费者组织的名单与说明,并提供这些组织的网页链接。
PART/3 作为专家参与其中
EMA主要通过其符合条件的组织网络与专家进行联系,但是有兴趣与EMA合作的个人也可以通过填写在线注册表将其纳入个人的利益相关者数据库。该数据库的目的在于识别参与EMA活动的患者与消费者,此外,注册者将收到其感兴趣领域的信息。EMA通过维护一个有兴趣参与EMA的代表不同适应症的患者的数据库,来进一步增加与患者和消费者的互动。
患者填写申请表,经过验证后会收到一封电子邮件形式的自动确认函。在注册时,需要提供姓名、电子邮件地址和电话号码,同时需要提供公民身份信息,以及与患者/消费者组织或EMA委员会或工作小组的成员/关系(如果有的话),此外,还需要说明对EMA活动感兴趣的领域。
事实上,患者、护理人员和消费者都被邀请在专家个人利益相关者数据库中注册。这些人员可以不具备医学或监管事务的背景,因为他们可以根据自己的实际生活经验提供有价值的信息;同时EMA也会提供支持和教育材料,确保EMA参加活动的患者和消费者做好准备。
这些注册的个人信息受到EMA的保护,而每个被纳入数据库的人都会收到一个个性化的链接,保证他们能随时更改数据。如果注册者希望注销数据库中的个人信息,随时可以通过电子邮件联系,要求从数据库中撤出个人信息,但是参加某些EMA的活动的信息可能会被保留在与活动相关的记录中。
患者参与发展历程
自1995年成立以来,EMA一直与患者进行积极互动,从最初与患者团体进行非正式讨论,到如今已经发展为更正式的互动,互动范围也由患者拓展到对药品感兴趣的消费者(如图3-5)。
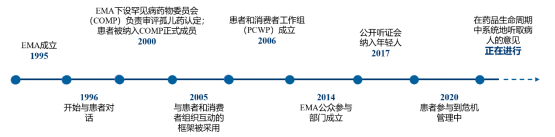
图3-5 EMA与患者和消费者互动的关键里程碑
经过20多年的合作,EMA现在已经建立了让患者参与其药物评估过程的全生命周期系统。患者通过三种不同的方式参与EMA的工作(如表3-5),分别为:正式成员或候补成员、患者组织代表和专家患者。
表3-5 患者参与EMA的角色和工作内容

顶层设计规划
(1)宏观政策
EMA积极与患者和消费者互动,同时出台相关法律要求将患者和消费者纳入EMA管理委员会和某些科学委员会,以及在药品评估或其他活动中咨询专家患者和组织。
EC No 726/2004法规中明确EMA管理委员会的成员组成中应包括两名患者组织的代表,同时规定管理委员会应与工业界、患者、消费者以及医疗界的代表展开适当的联系。此外,明确了EMA各科学委员会与患者和消费者联系的责任,即EMA科学委员会设立的工作组或科学咨询小组应在一般事项上与医药产品使用有关的各方,特别是患者组织和卫生专业人员建立咨询性质的联系。同时,法规要求EMA与患者和消费者组织及其代表的具体互动形式。例如,患者可以成为EMA管理委员会、孤儿药委员会(COMP)、儿科委员会(PDCO)、先进疗法委员会(CAT)和药物警戒风险评估委员会(PRAC)的代表参与EMA的工作。
在EC No 141/2000法规中明确了孤儿药委员会(COMP)的成员组成,其中包括了由委员会提名的代表患者组织的三名成员。委员会的任务在于审查孤儿医疗产品、就建立和发展欧盟孤儿医疗产品政策向委员会提出建议,就有关孤儿医疗产品的事项进行国际联络,并与病人支持团体进行联络等。
欧洲议会和理事会于2006年颁布关于儿科药品的EC No 1901/2006法规,在法规中明确儿科委员会(PDCO)的成员组成中需包括代表患者群体的三名委员和三名候补委员。
欧洲议会和理事会于2007年颁布关于先进治疗药物的EC No 1394/2007法规,同样明确了先进疗法委员会(CAT)的组成应适当涵盖与先进疗法相关的科学领域,具有先进治疗药物科学经验的患者协会应当参加委员会。委员会应根据公开征求意向并咨询欧洲议会后任命两名成员及两名候补成员,以代表患者群体。
在EC No 1235/2010法规中明确了药物警戒风险评估委员会(PRAC)的成员组成,其中包括一名委员和一名候补委员,由委员会在征求欧洲议会意见后,在公开征集的意向的基础上任命,以代表患者组织。
(2)微观政策
EMA与患者和消费者组织的互动框架最初由管理委员会于2005年通过,并于2014年修订。随着经验的增加、新法规的出台、科学的进步和危机情况的出现,该框架也在不断修订完善。2022年框架的标题为《参与框架:欧洲药品管理局和患者、消费者及其组织》。框架描述了EMA与患者和消费者及其组织针对药物进行接触的目标和方法。EMA致力于确保将患者的声音纳入药物生命周期的不同监管活动中,了解患者的观点,以促进药品的安全合理使用。为了实现这一目标,EMA认为必须与包括患者、消费者、医疗保健专业人员和学术团体在内的各利益相关方进行密切合作。迄今为止的经验表明,患者参与该机构的活动,使监管过程的透明度和信任度得到提高,监管者与患者和消费者群体之间的相互尊重感得到加强。同时患者和消费者群体对药品评估的贡献丰富了科学委员会和工作小组的意见的质量。
患者参与药物监管的实践模式
PART/1 欧洲患者和消费者组织网络
EMA和欧洲各地具有不同专长的组织建立了互动关系,EMA同时制定了一套选择组织的资格标准(经EMA管理委员会批准)。其中患者组织是以患者为中心的非盈利组织,这些组织可以是一般的伞状组织或者是特定的疾病组织。
PART/2 患者和消费者工作组(PCWP)
2006年,EMA成立了患者和消费者工作组(the EMA Patients and Consumers Working Party,PCWP),这是一个信息交流论坛,PCWP在EMA和患者组织之间的互动起着关键作用,PCWP就与患者和消费者直接或间接有关的所有事项向EMA及其人类科学委员会提供建议。通过PCWP,EMA将向患者和消费者汇报EMA的各种活动,并获得他们的意见和反馈。最终PCWP有望通过支持EMA将真实世界数据引入监管科学中,促进药品使用更安全、合理,为EMA推进公众健康的战略目标做出贡献。
工作小组的成员包括患者和消费者组织、科学委员会成员以及来自管理委员会和欧盟委员会的观察员。PCWP工作组每年召开3~4次会议,根据实际需要进行“个案”咨询。讨论议题包括优先药品计划(Priority Medicines,PRIME)、欧盟新法规的实施。
患者和消费者工作组会议
2002年EMA及其专利药品委员会(CPMP)与七个欧洲患者和消费者组织的代表组织了第一次研讨会,本次研讨会的目的是加强与患者代表的沟通,就药品相关信息交换意见,并进一步探讨对监管活动的贡献。此后,在2004年、2006年至2022年相继举行多次会议。
患者和消费者工作组的成员
(1)“符合条件的患者和消费者组织”的核心代表小组(Eligible patients' and consumers' organisations)
欧洲药品管理局(EMA)与超过35个符合条件的组织网络合作,确保通过与该机构的直接联系来代表广泛的患者和消费者的需求和关注点。这些组织是非营利性的,在大多数情况下具有欧盟范围内的授权。符合条件的组织会收到有针对性的EMA沟通和咨询,并经常协助确定针对特定产品事务的专家。成为符合资格组织并不会自动授予患者和消费者工作组(PCWP)的会员资格。
PCWP成员组织包括欧洲阿尔茨海默病组织、欧洲艾滋病治疗小组、欧洲癌症联盟、欧洲消费者组织、欧洲罕见病组织、欧洲公共卫生联盟等组织,同时还有先进治疗药物委员会、人用药品委员会、孤儿药委员会、儿科用药委员会、药物警戒风险评估委员会等科学委员会参加。
EMA秘书处根据其患者-消费者组织成员和工作小组任务范围内所涉及的主题的相关性,在征集意向后从EMA符合条件的成员名单中选出。将涵盖以下领域:普通消费者组织、普通患者组织,对孤儿药、艾滋病毒/艾滋病、癌症、糖尿病、神经退行性疾病或自身免疫性疾病及其他免疫功能障碍感兴趣的组织。
(2)EMA科学委员会的代表(EMA's scientific committees)
EMA每个人用药品科学委员(包括先进疗法委员会、人用药品委员会、孤儿药委员会、草药产品委员会、儿科委员会、药物警戒风险评估委员会)会应提名一名代表和一名候补代表作为PCWP工作组的成员,委员会代表负责与他们所属的委员会联络,以便向工作小组提供相关议题(即讨论和思考的要点),并向委员会通报工作小组的活动。
(3)观察员(observers)
①欧盟管理委员会
欧盟管理委员会的成员在管理方面具有专业知识,且在人用药品或兽用药品领域具有一定经验。他们被选中以保证最高水平的专业资格,广泛的相关专业知识和欧盟内尽可能广泛的地理分布。
管理委员会由以下成员组成:每个欧盟成员国一名代表;欧盟委员会的两名代表;两名欧洲议会代表;两名患者组织代表;一名医生组织代表;兽医组织的一名代表。除成员外,管理委员会还分别有一名来自冰岛、列支敦士登和挪威的观察员。
成员国、欧盟委员会和欧洲议会的代表由成员国和有关机构直接任命。四名“民间社会”董事会成员(患者、医生和兽医代表)由欧盟理事会在欧洲议会协商后任命。成员国和委员会的代表可有候补代表。董事会成员的任期为三年,可以连任。
②欧盟委员会
作为欧盟执行机构,其负责欧盟各项法律文件(指令、条例、决定)的具体贯彻执行,以及预算和项目的执行。和欧洲法院一起保障共同体法律被切实遵守。自2003年2月《尼斯条约》开始生效后,欧盟各成员国都选派一名委员。委员会的成员之间互相平等,共同制定政策。欧盟委员会和欧洲议会一样,每届任期五年。
③医护专业人员工作小组(Healthcare Professionals' Working Party)
医护专业人员工作小组(HCPWP)为欧洲药品管理局和医疗保健专业人员之间交流信息和讨论共同关心的问题提供了一个平台。HCPWP成立于2013年,使该机构能够在与医疗保健专业人员的现有互动的基础上再接再厉,从而就与药物有关的所有相关事项向EMA及其人类科学委员会提供建议。
④分权程序和互认程序小组
分权程序(Decentralised procedure):在一个以上的欧盟成员国并行授权药物的程序。它可用于不需要通过集中程序授权且尚未在任何成员国获得授权的药物。经分权程序审批的产品为互认可产品。
互认程序(Mutual recognition):一个欧盟成员国的授权药物得到另一个成员国承认的程序。
PART/3 促进患者参与到EMA监管的全生命周期
EMA科学监管涉及药物研发的整个生命周期(如图3-7),在EMA评估药品的7个委员会中,包括6个人用药品科学委员会和1个兽用药品科学委员会,患者在其中的4个委员会拥有投票权,包括孤儿药委员会(Committee for Orphan Medicinal Products,COMP)、儿科用药委员会(Paediatric Committee,PDCO)、先进疗法药物委员会(Committee for Advanced Therapies,CAT),以及药物警戒和风险评估委员会(Pharmacovigilance Risk Assessment Committee,PRAC)。
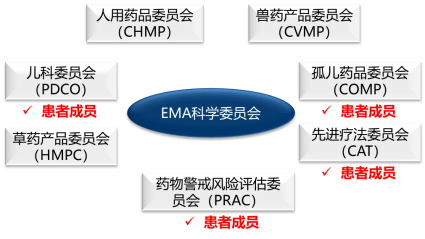
图3-6 EMA科学委员会组成
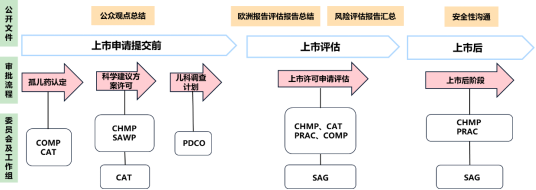
图3-7 欧洲药品管理局患者参与的药品的全生命周期流程
(数据来源:EMA网站整理与公开数据整理)
图3-7显示了患者参与药品监管途径的概况,可以分为上市申请提交前、上市评估与上市后阶段。在上市申请提交前阶段,患者作为科学委员会的一员,参与科学建议协助程序,为委员会提供药物有关的咨询意见,也系统地审查为公众撰写的关于孤儿药认定的摘要。对于上市评估和上市后阶段,患者除了作为委员会成员参与之外,还被邀请参加科学专家会议,对特定药品进行讨论与评估。此外,患者还参与审查欧洲公共评估报告(EPAR)和风险评估报告,对面向公众的文件进行审查,确保内容的可读性且适合目标受众。
迄今为止的经验表明,患者参与EMA的活动,提升了监管程序的透明度,促进了监管机构与患者和消费者群体之间的相互尊重和信任,改善了科学委员会提出的意见的质量。
PART/4 能力建设
EMA为受邀参加其活动的患者和消费者代表提供支持、培训课程,并为有兴趣了解有关EMA更多活动信息的人提供一系列培训视频和文件。这些信息有助于感兴趣的患者和消费者代表了解EMA的工作、患者和消费者参与的活动类型。
EMA在官网提供了其针对患者和消费者开发的一系列名为“EMA基础知识”的培训视频及相关文档。同时,EMA每年为参与其活动的患者和消费者举办为期一天的培训课程。该会议特别强调了何时以及如何参与,参与者可以了解他们如何为药物监管活动、EMA科学会议等做出贡献。
同时,EMA还举办网络研讨会。例如在2022年6月PCWP和HCPWP举办了先进治疗药品(ATMP)信息会议。EMA还会通过外部培训来促进符合资格的组织更好地了解药物的开发和批准以及患者和消费者参与的过程。例如欧洲患者学院(EUPATI)项目、药物研究与开发开放学院、欧洲患者大使计划(EPAP)等。
PART/5
患者参与药物监管具体实践
在一次EMA组织的科学会议上,骨质疏松症患者强调,除了髋部运动之外,还应将腕部运动纳入终点指标的重要性。对于骨质疏松患者来讲,腕部运动非常重要,诸如日常生活中的穿衣、化妆、冲茶等“小事”,都离不开腕部运动,但医药公司和其他专家却忽略了。
在有关治疗软组织肉瘤的一个药品的讨论中,一位患者对相关医药公司选择将目标人群限制为预后较好的人群做法提出了挑战,这导致了有关纳入标准与可解释性试验数据的同质性的进一步讨论。这位患者还提供了对拟采用的治疗药物毒性的看法,陈述了患者可能如何看待它,以及其对试验入组率和脱落率的可能影响。
患者参与药物监管实践成效
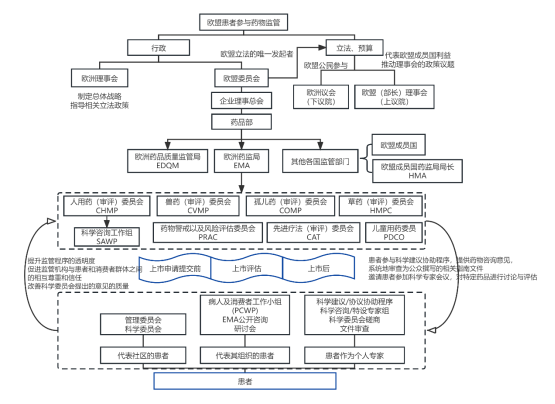
图3-8 欧盟患者参与药物监管框架图
PART/1 利益相关者参与情况
EMA每两年发布一次关于其与患者、消费者、医疗保健专业人员,学者及其组织的互动的报告。其中,EMA对所有符合条件的组织进行了两年一次的满意度调查,共收到了82名患者和医疗保健专业人员关于他们参与EMA活动的反馈。超过91%的受访利益相关者表示,他们对与EMA的互动感到满意或非常满意,超过78%的人认为他们的贡献有用或非常有用。他们所提供的意见将为未来参与的活动提供信息。
PART/2 科学建议
EMA一直尽可能地让患者参与科学会议,如科学建议和科学建议特设专家组会议。科学建议(scientific advice,SA)是关于向药物研发人员提供合适的研究方法,药物研发人员可以就他们正在开发的药物向EMA寻求最佳方法和研究设计的指导。EMA提供科学建议设计研究是因为其可能帮助产生可靠和完整的数据,更有效的利用有限的科学资源,造福患者。
研究人员可以在药物研发的任何阶段申请,可能涉及:
生产质量方面(药物制造、生物测试)
非临床方面(实验室中显示药物活性的毒理学和药理学测试)
临床方面(患者或健康志愿者研究方案的是否合适,终点的选择等)
方法问题(使用的统计测试,数据分析等)
EMA人用药品委员会(CHMP)负责上市许可申请,其主要职责之一是提供科学建议来支持研究和开发,这项任务由CHMP移交给EMA的科学咨询工作组(SAWP),即SAWP负责回答开发人员提出的问题,最终建议由CHMP正式采用并发布。其中患者作为药物的最终用户,是EMA的主要利益相关者,EMA邀请患者分享他们在疾病领域中与特定药物相关的现实生活观点与经验。这将帮助药物开发人员和监管机构更好地理解患者的诉求。
EMA于2022年1月发表一篇文章,以科学建议为案例研究,在四年的时间内收集数据,以评估参与的患者数量、贡献以及他们的投入带来的影响和附加值。
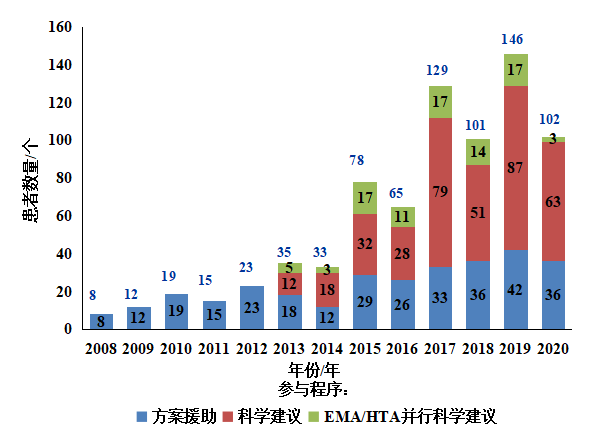
图3-9 2008年至2020年参与的患者数量,按程序类型划分
(注:关于患者参与科学咨询程序的数据收集始于2008年)
图3-9显示了参与科学建议的患者数量(按不同类型划分),实际上患者参与科学咨询始于2005年,当时罕见病患者要求参与孤儿药的方案协助程序,这一活动的成功使得EMA从2013年起将患者纳入对未被指定为孤儿药的药物的科学建议以及科学建议和卫生技术评估(HTA)机构的并行程序中。
调查结果显示,在2017-2020年的研究期间,EMA共收到478名患者的371份调查回应,他们参与了临床开发相关的科学建议程序,2017年(90/129;70%)、2018年(75/101;74%)、2019年(110/139;79%)和2020年(96/102;94%)每一年的结果都显示了高回复率。
图3-10显示,患者最常参与临床试验人群的选择(49%)、终点的选择(48%)、生活质量研究(37%)、研究的可行性(29%),同时引入了与病情相关的真实生活的视角(作为患者或护理人员),提供了不同于医学和科学专家的观点,并提出了科学建议工作组之前没有考虑过的问题。“其他”领域包括对病情、日常影响和治疗方案的一般见解。总的来说,在超过一半的案例(52%)中,患者的意见导致工作小组进一步的思考。
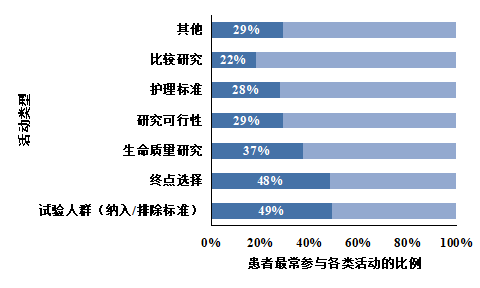
图3-10 患者提供意见的领域(调查问题可多选)
调查还衡量了提供给研究人员的科学建议是否因病人的意见而被修改,结果显示,在20%的案例中,最终的建议根据患者的意见被修改。在没有被修改的案例中,90%的患者同意草拟的开发计划。
图3-11显示了患者意见的附加值,其中“带来病情和治疗的真实生活经验”(71%)排名最高,其次是“提供不同的观点”(42%),以及“提出以前没有考虑的问题”(14%)。这些方面补充了对研究人员在临床试验方面提出的具体问题的贡献。
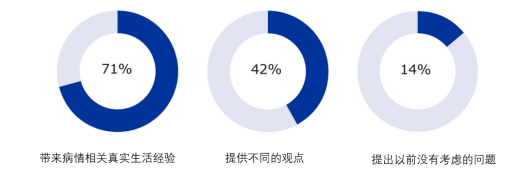
图3-11 患者的额外贡献
PART/3 科学咨询小组(SAG)和特设专家组
科学咨询小组(Scientific Advisory Groups,SAGs)由CHMP创建,就与正在评估的产品相关的科学/技术问题或与委员会工作相关的任何其他科学问题提供独立建议。当问题涉及的治疗领域尚未成立特定SAG的时,将组织一个特设专家组,并遵循SAG的授权。SAG由根据其特定专业知识选出的专家组成,CHMP可酌情任命患者和消费者代表作为额外专家参加SAG会议。
2020年,42名患者和护理人员参加了22次SAG/特别会议,2021年,25名患者和护理人员为14次SAG/特别会议提供了意见。患者分享了他们在神经病学、肿瘤学、血液学和病毒病等治疗领域的经验。
PART/4 文件审查
发给患者和公众的文件在出版前由患者审查。患者提出的建议和意见有助于确保文件面向目标受众,并使用正确的语言确保信息清晰易懂。如图3-12所示,由于审查机构一直根据业务连续性计划开展工作,因此对草药摘要的审查在2021年被搁置。
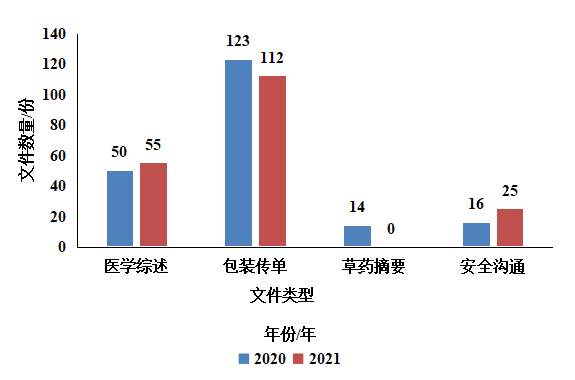
图3-12 审查EMA文件