近日,REGENXBIO公司宣布,在研基因疗法RGX-121在治疗II型黏多糖贮积症(MPS II)的关键性临床试验中达到主要终点,患者的脑脊液D2S6水平平均降低86%,接近正常水平,D2S6是大脑疾病活动的关键生物标志物之一。此前,RGX-121用于治疗19岁以下MPS II患者的1/2/3期试验数据积极,且有报道显示RGX-121使患者持续获益已达三年。这些结果支持该公司在2024年使用加速批准通道向美国FDA递交生物制品许可申请(BLA)。值得一提的是,RGX-121已获得美国FDA授予的孤儿药资格、罕见儿科疾病认定、快速通道资格和再生医学先进疗法认定。

RGX-121是一种基因疗法,旨在使用AAV9载体将编码人艾杜糖酸-2-硫酸酯酶(IDS)的转基因递送至中枢神经系统(CNS),向CNS细胞内递送IDS转基因可以为患者提供一个永久性的IDS分泌源,并能突破血脑屏障,从而纠正或修复周围细胞的遗传缺陷或功能异常。
长期随访数据显示,在接受关键性试验阶段,按推荐剂量进行治疗的患者中,80%的患者在最近一次随访时不需要接受标准的静脉输注酶替代疗法。截至2024年1月3日,在这一临床试验中接受治疗的25名患者都表现出良好的耐受性。
REGENXBIO凭借独家平台,与艾伯维达成超十亿美元合作
REGENXBIO是一家领先的临床阶段生物技术公司,致力于AAV基因疗法的开发和商业化。REGENXBIO的重要优势在于其专有的AAV基因递送平台NAV,这一技术平台包括了AAV7、AAV8、AAV9等100多种其他新型AAV载体(NAV 载体)的专有权,专为克服早期AAV载体(AAV1到AAV6)的免疫原性而研发的,其主要有6大优势:
1)能够用于多种遗传物质的递送;
2)更易生产制造;
3)所产生的免疫反应可能性更小;
4)能够以更小的剂量实现更持久的疗效;
5)源自天然来源,支持多重修饰用于疾病治疗;
6)能够广泛应用于多种疾病的治疗。例如,递送至肝脏的基因疗法具有治疗血友病等代谢疾病的潜力,而递送至CNS的基因疗法主要治疗影响大脑和认知相关的疾病。

▲NAV平台优势 图片来源:REGENXBIO官网
这一核心平台除了支持REGENXBIO内部进行管线研发外,REGENXBIO还将其授权给了各大药企,包括诺华、礼来、辉瑞、武田、安斯泰来等。
2021年9月,艾伯维与REGENXBIO宣布达成一项战略性合作协议,共同研发并商业化RGX-314(ABBV-RGX-314),艾伯维将向REGENXBIO支付3.7亿美元的预付款,以及后续可能高达13.8亿美元的额外开发、监管和商业里程碑付款。要知道,10年销售额破2000亿美元的“药王”修美乐便出自艾伯维之手,大牛的技术支持与巨额资金对于一个基因疗法新锐来说,就是锦上添花。
RGX-314使用AAV8载体携带表达抗VEGF抗体片段的转基因,在体内表达的蛋白通过阻断VEGF信号传导,抑制心血生成和视网膜液体聚集,用于稳定或改善湿性湿性年龄相关性黄斑变性(AMD)患者的视力。
2024年初,REGENXBIO公司宣布,与艾伯维(AbbVie)公司联合开发的在研基因疗法RGX-314在治疗湿性年龄相关性黄斑变性(AMD)的2期临床试验中获得积极中期结果。接受治疗的患者表现出良好的安全性和耐受性。接受最高剂量RGX-314治疗的患者组随后接受抗血管内皮生长因子(VEGF)治疗的需求降低达80%。此外,在六个月后仍显示出稳定的最佳矫正视力(BCVA)和中心视网膜厚度(CRT)。
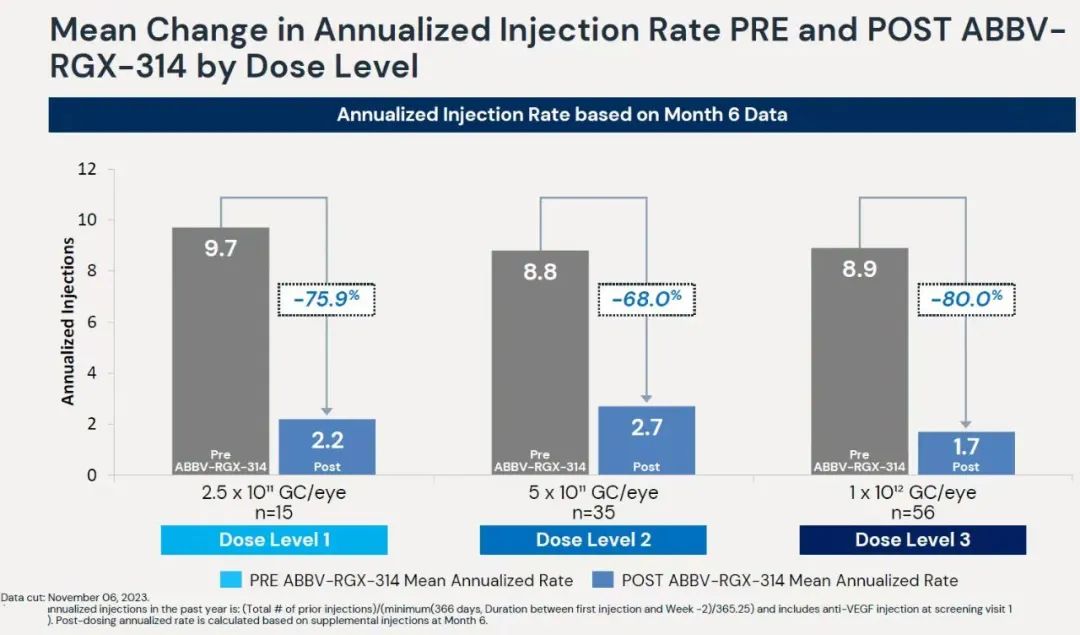
▲ABBV-RGX-314治疗显著降低患者接受抗VEGF治疗的需求
(图片来源:REGENXBIO公司官网)
在治疗湿性AMD之外,两家公司也在探索RGX-314治疗糖尿病视网膜病变和其他慢性视网膜疾病的潜力。
2023年11月,REGENXBIO公布了战略重组计划和2023年第三季度财报,精简管线,裁员15%,旨在大幅降低运营费用,将现金跑道延长至2025年下半年。同时,专注于三款AAV基因治疗临床阶段的项目开发,RGX-314(湿性AMD和糖尿病视网膜病变)、RGX-202(DMD)和RGX-121(黏多糖贮积症Ⅱ型)。而对于RGX-111(黏多糖贮积症I型)、RGX-181(巴顿病)和RGX-381(Batten病眼部表现)等管线则计划寻求战略代替方案。
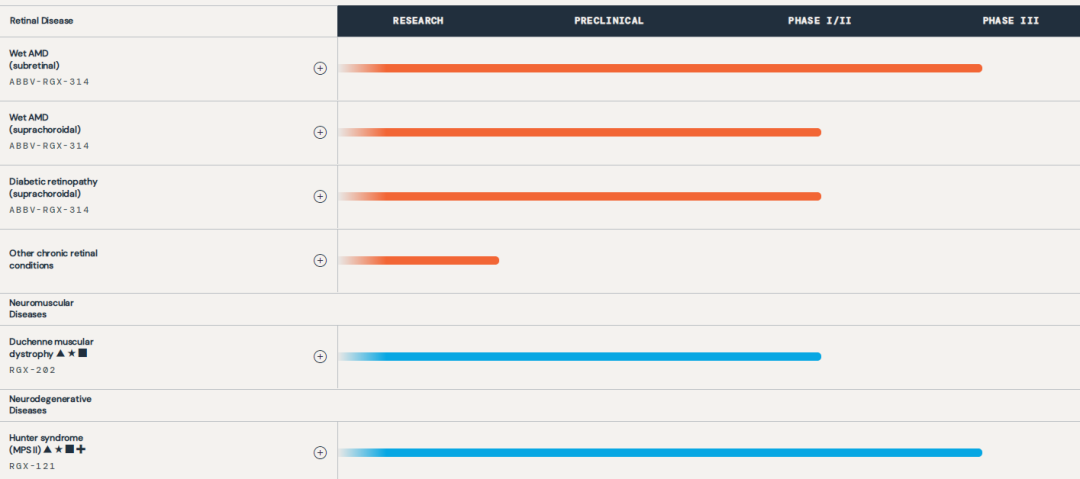
▲REGENXBIO在研管线 图片来源:REGENXBIO官网
今年有望上市的三大基因疗法 目前全球已有35款基因治疗药物获批上市,其中体外基因疗法17款;基于病毒载体的体内基因疗法16款。据Frost&Sullivan测算,全球的CGT市场规模从2016年的0.5亿美元迅速提高到2020年的20.8亿美元,年均增长率达到154%,预计将于2025年突破300亿美元关口。随着CGT领域在全球范围内的迅猛发展,进入基因疗法上市预备选手的队伍也日益壮大,除了即将拿到RGX-121外,还有三款基因疗法离今年上市仅一步之遥。
SPK-9001—辉瑞
2023年6月27日,辉瑞宣布,其基因疗法fidanacogene elaparvovec(SPK-9001)用于治疗B型血友病的BLA申请获美国FDA受理并予以优先审评,FDUFA日期为2024年Q2。与此同时,该产品的营销授权申请(MAA)也已被欧洲药品管理局(EMA)受理。

SPK-9001是Pfizer/Spark开发的一款针对血友病B的基因治疗药物,由具有肝特异性的生物工程衣壳AAV2,肝特异性启动子和密码子优化的FIX-Padua转基因组成。对于血友病B患者来说,这种基因治疗的目标是使他们能通过一次性治疗产生自体的FIX蛋白,而非像目前的标准治疗那样需要定期静脉输注FIX。
辉瑞表示,SPK-9001疗法与标准的凝血因子替代疗法一样有效甚至更好。与标准治疗相比,该药物将接受治疗的患者的年出血率降低了71%,需要治疗的出血率降低了78%。辉瑞SPK-9001的申报上市,将与350万美元的Hemgenix在B型血友病基因疗法领域展开激烈竞争。
RP-L201—Rocket Pharma
2023年10月2日,基因疗法RP-L201提交上市申请获FDA受理,并被授予优先审评资格,用于治疗严重罕见的遗传性免疫疾病白细胞粘附缺陷病-I型(LAD-I),PDUFA日期为2024年3月31日。RP-L201含有自体造血干细胞,这些干细胞已经利用慢病毒载体进行了基因改造,能够使ITGB2基因正常表达。患者接受一种称为白消安(busulfan)的化疗药物后,RP-L201被返回到患者体内,以去除现有的骨髓细胞,为RP-L201的生长腾出空间。

RP-L201治疗LAD-I患者的全球性I/II期研究达到了所有主要终点和次要终点。数据显示,接受RP-L201治疗12个月(以及整个随访期间)后,患者(12-24岁,9例)的总体生存率为100%。与治疗前相比,患者严重感染发生率大幅下降,LAD-I相关皮肤损伤症状消退,伤口修复能力也有所恢复。此外,RP-L201耐受性良好。
pz-cel—Abeona Therapeutics
2023年11月27日,Abeona Therapeutics宣布,基因疗法pz-cel(EB-101)提交上市申请获FDA受理,美国FDA已接受其在研基因疗法的生物制品许可申请(BLA),并授予优先审评资格,PDUFA目标日期为2024年5月25日。

Pz-cel由表皮片组成,旨在将功能性、产生胶原的COL7A1基因整合到患者自身的皮肤细胞中,并通过使用逆转录病毒载体稳定整合到分裂的靶细胞基因组中,实现长期基因表达,并促进伤口愈合,用于隐性营养不良性大疱性表皮松解症(RDEB)患者的治疗,该BLA申请主要获关键3期VIITAL研究以及另一项1/2a期研究的临床疗效和安全性数据支持。两项研究均显示,在大型和慢性伤口上单次应用pz-cel治疗可实现持续伤口愈合和疼痛减轻。
结语 FDA 曾在多个场合表示,预计到2025年,每年将批准10至20种CGT疗法。并且,除了热门的眼科疾病外,基因疗法的适应症还将囊括中枢神经系统疾病、心脑血管疾病、乃至皮肤病等更广泛临床需求的领域,基因治疗药物的繁花时代即将来临。然而,在这耀眼光芒的背后,我们也必须正视基因疗法所面临的严峻挑战,高昂的生产成本、安全性以及递送难题等。这也迫使研发人员对衣壳进行改造与进化,以寻求更具组织特异性、更高效、更安全的载体。未来AAV基因疗法有望拓展更多“版图”,发挥更大潜力。
参考资料:
1.https://www.biospace.com
2.https://www.regenxbio.com
3.各企业官网