从1968年第一个限制性内切酶的发现、到1985年聚合酶链式反应(PCR)技术的发明,再到2013年CRISPR-Cas9基因编辑技术的应用,生物技术的每一个突破性发现都进一步提高了我们操纵DNA,乃至调控生命蓝图的能力。
线粒体(mitochondrion)是细胞的“能量工厂”,线粒体内有一套独立于细胞核的遗传物质——线粒体DNA(mtDNA),人类线粒体DNA的长度为16569bp,拥有37个基因,编码13种蛋白,这些蛋白都参与细胞的能量代谢。由于线粒体在能量稳态中的重要作用,线粒体DNA中的点突变就可导致发育障碍、神经肌肉疾病、癌症进展等等多种严重疾病,大约5000人中就有1人患线粒体疾病。
基因编辑技术在细胞核基因组的编辑中取得了辉煌的成绩,但是在线粒体基因组编辑中却滞后很多。开发针对线粒体DNA的基因编辑工具一直是线粒体遗传学领域的长期目标,也是研究和治疗线粒体疾病的有力工具。
2023年11月30日,迈阿密大学米勒医学院和Precision公司的研究人员在 Nature 子刊 Nature Metabolism 上发表了题为:Efficient elimination of MELAS-associated m.3243G mutant mitochondrial DNA by an engineered mitoARCUS nuclease 的研究论文。
该研究开发了一种线粒体靶向的ARCUS核酸酶——mitoARCUS,该核酸酶被设计用于特异性靶向和切割线粒体DNA(mtDNA)的致病性m.3243G点突变。
在含有95%突变m.3243G的线粒体DNA的细胞中,mitoARCUS可以消除所有含有突变的线粒体DNA,而不影响正常线粒体。这些正常线粒体DNA随后能够被细胞快速复制,以保持线粒体DNA拷贝数的稳定。通过消除突变线粒体DNA并允许正常线粒体DNA的重新复制,mitoARCUS驱动了突变线粒体向健康线粒体的转变,这一过程被称为异质性转换(shifting heteroplasmy)。
该研究还通过AAV递送mitoARCUS的系统给药,证明了mitoARCUS在体内编辑线粒体DNA的有效性。这些实验数据支持了mitoARCUS作为m.3243A>G相关线粒体疾病的体内基因编辑疗法的开发。

论文通讯作者、迈阿密大学米勒医学院的 Carlos Moraes 教授表示,迄今为止,线粒体疾病没有治愈性的治疗方法,基因编辑技术作为一种新方法,为线粒体疾病患者带来希望。 然而,许多基因编辑技术,特别是基于CRISPR的基因编辑技术,由于其复杂的多组件,一直无法有效地靶向突变的线粒体DNA,因此它们被认为不是线粒体疾病的有效治疗选择。mitoARCUS的简单性使其成为第一种不仅能够区分m.3243A>G点突变,还能有效地消除这一点突变的方法,能够使正常的线粒体DNA在细胞内重新复制并恢复功能。这一令人兴奋的进展有望为患有m.3243突变相关原发性线粒体疾病的患者带来治愈性治疗方法,并且ARCUS技术将来还可能被应用于研究和治疗其他线粒体疾病。
线粒体脑肌病伴高乳酸血症和脑卒中样发作(mitochondrial encephalopathy,lactic acidosis,and stroke-like episodes),简称MELAS综合征,是一种多系统线粒体疾病,也是最常见的线粒体脑肌病。其具体症状因人而异,但通常包括反复卒中样发作、脑病和乳酸积累。完全症状患者出现神经系统症状后的中位生存时间约为17年,平均死亡年龄为34.5±19岁,目前尚无治愈这种疾病的方法。
MELAS综合征涉及多个线粒体DNA(mtDNA)基因突变,包括MT-TL1、MT-TK、MT-TQ和MT-ND5等,其中最常见的突变位点是在编码线粒体tRNALeu(UUR)的MT-TL1基因中。特别是,mtDNA的3243位点的A>G点突变(m.3243A>G)导致了>80%的MELAS综合征。此外,除了MELAS综合征,m.3243A>G突变还与多种其他临床表型相关,包括听力丧失、偏头痛、肌肉无力和糖尿病等,总体而言,m.3243A>G突变的人群患病率估计高达1/400。
ARCUS是由Precision公司的科学家发现和开发的专有基因组编辑技术。它使用序列特异性的核酸酶来切割DNA,能够在细胞和生物体体内实现对DNA的敲除和敲入。ARCUS基于一种天然产生的基因组编辑酶I-CreI重新设计改造而来,I-CreI是在莱茵衣藻中进化,可在细胞DNA中进行高度特异性切割,并通过同源重组实现在切割位点的基因敲入。
此前,Precision公司已经将不同的ARCUS核酸酶应用在了敲除胆固醇代谢基因、转甲状腺素蛋白淀粉样纤维生成基因、灭活乙肝病毒,以及构建同种异体CAR-T细胞等领域。
2021年,他们发现了一种线粒体靶向的ARCUS核酸酶——mitoARCUS,可以通过腺相关病毒9型(AAV9)进行系统性递送,在小鼠体内消除线粒体DNA的m.5024C>T点突变【2】。
对于线粒体DNA的基因编辑而言,ARCUS相比ZFN、TALEN以及基于CRISPR的可编程基因编辑技术具有几点优势:ARCUS是一种单组分蛋白质,可以同时识别DNA和产生DNA双链断裂(DSB),其大小仅为约1100bp,可使用单个AAV载体递送,而且,可以对其优化底物识别相关氨基酸,以提高活性和特异性,从而产生高度特异性的ARCUS核酸酶。
基于ARCUS的这些特点,以及线粒体DNA中m.3243G点突变的流行,研究团队开发并优化了一种能够特异性识别和切割线粒体DNA的m.3243G点突变的mitoARCUS核酸酶。
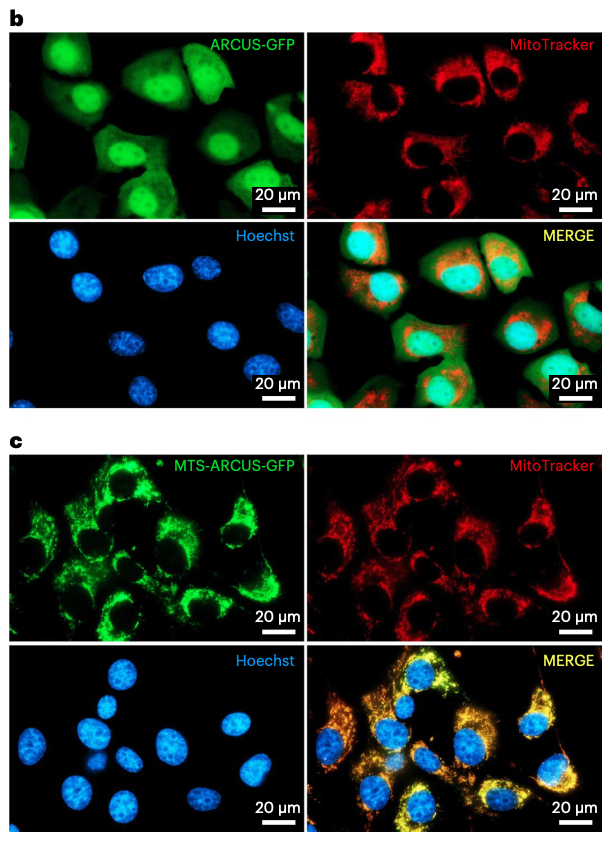
添加了线粒体靶向序列(MTS)的mitoARCUS,可定位到线粒体
实验结果显示,mitoARCUS核酸酶具有高度特异性,能够高效切割携带m.3243G点突变的线粒体DNA,从而通过异质性转换(shifting heteroplasmy),驱动正常线粒体DNA的复制,恢复线粒体功能。这一过程没有任何因消除突变线粒体DNA产生的瞬时线粒体DNA耗竭相关毒性。
此外,研究团队还mitoARCUS核酸酶的细胞核基因脱靶编辑进行了表征,并确定除了添加线粒体靶向序列(MTS)外,还可以通过添加出核序列(NES)进一步保护细胞核基因组。
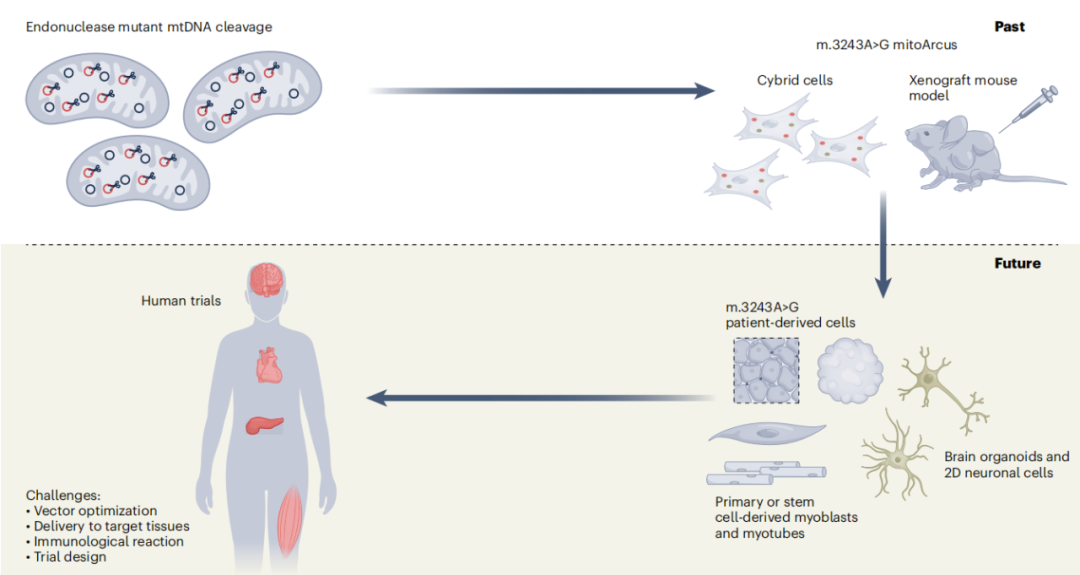
最后,研究团队开发了携带线粒体DNA的m.3243G点突变的新型小鼠模型,并通过AAV递送mitoARCUS的系统给药,证明了mitoARCUS在体内编辑线粒体DNA的有效性。这些实验数据支持了mitoARCUS作为m.3243A>G相关线粒体疾病的体内基因编辑疗法的开发。

Precision公司首席研究官 Jeff Smith 博士表示,对于线粒体疾病,ARCUS之所以成为如此优雅和简单的工具,是因为它是一个单组分蛋白质,可以识别和消除突变的线粒体DNA。这项新发表的论文进一步验证了ARCUS克服基于CRISPR的基因编辑技术的限制的能力,用于治疗线粒体疾病,并以高特异性消除突变的线粒体DNA,以改善整体线粒体功能。此外,这些数据突出了设计ARCUS核酸酶的能力,以区分突变和野生型DNA序列之间的单碱基变化,即使在非常高的剂量水平下也是如此。这些数据增强了我们对治疗原发性线粒体肌病的新疗法PBGENE-PMM的信心,我们期待在2025年将该疗法推进到临床试验阶段。