2023年12月6日,诺华宣布FDA批准Iptacopan(商品名:Fabhalta)上市,用于成人阵发性睡眠性血红蛋白尿症(PNH)患者的治疗。这是首个获FDA批准的口服治疗成人PNH的药物。

PNH是一种补体介导的慢性罕见血液疾病。据统计,PNH发病率约百万分之一到二,亚洲人群发病率高于欧美,可在任何年龄发生,常见于30-40岁人群。PNH患者体内PIG-A基因突变,导致血细胞表面上重要的补体调节蛋白CD55和CD59缺失。因此,细胞更易被补体激活。临床主要表现为溶血、骨髓造血功能衰竭和血栓形成等。抗补体C5疗法(依库珠单抗或Ravulizumab)是既往国际公认的PNH标准治疗,但在抗C5治疗后,仍有大部分患者有残留贫血、疲乏和输血依赖,严重影响生活质量。
FDA 的批准是基于 III 期 APPLY-PNH 试验,该试验针对是先前接受过抗 C5 治疗但仍患有贫血(血红蛋白 < 10 g/dL)的患者,这些患者转而使用 Fabhalta;试验证明在不输注 RBC 的情况下,该药物在改善血红蛋白方面具有优越性。
Iptacopan是全球首创的小分子补体B抑制剂,有望治疗多个适应症。
Iptacopan已获得国家药品监督管理局药品审评中心(CDE)突破性治疗药物的认定,用于成人阵发性睡眠性血红蛋白尿症(PNH)和C3肾小球病(C3G)患者的治疗。除此之外,正在开发治疗IgA肾病(IgAN)、非典型溶血尿毒综合征(aHUS)、狼疮性肾炎(LN)等多个补体相关肾病适应症。
2023年6月份,CDE正式受理Iptacopan胶囊的上市许可申请并将其纳入优先审评程序,其适应症为成人阵发性睡眠性血红蛋白尿症(PNH)。
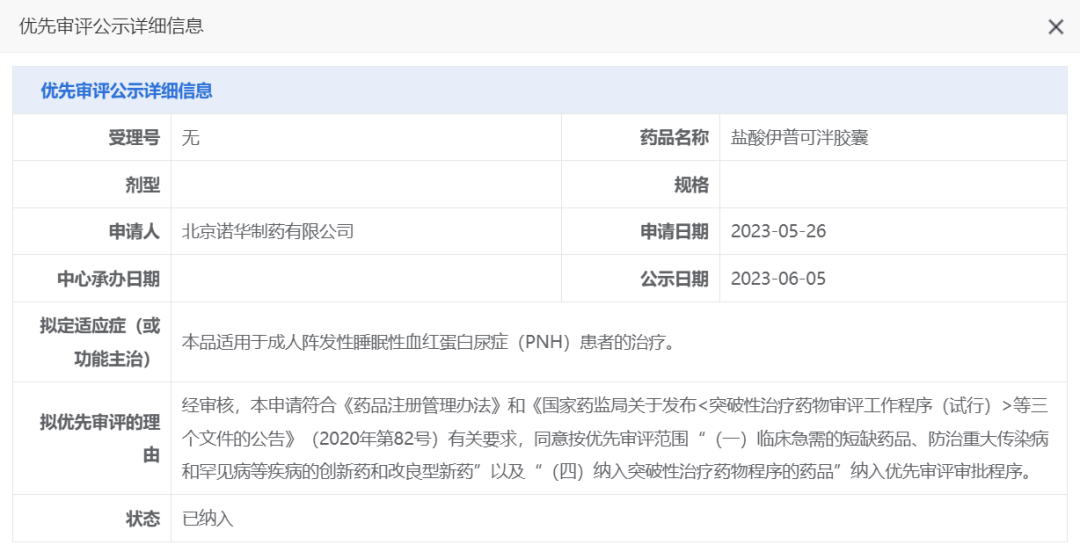
图片来源于CDE官网
该药物,预计明年在国内获批上市。