8月14日,濒临退市的专注于开发中枢神经系统单基因遗传病AAV基因疗法的Taysha公司绝地逢生,完成1.5亿美元的融资,公司的现金资产因此可支撑到2025年第三季度。此次融资由新投资者RA Capital Management领投,PBM Capital,GordonMD® Global Investments LP等大型投资机构参与其中,主要用于支持TSHA-102在Rett综合征中的临床开发,并为TSHA-120在巨轴索神经病变(GAN)中的项目活动和其他一般企业用途提供支持。
基因治疗生来就是要啃硬骨头的。Taysha专注于中枢神经系统(CNS)疾病的做法不可谓不激进。因为血脑屏障的存在,CNS疾病的新药研发非常困难。自古以来,一切激进的人和事都注定要经历大风大浪,大起大落。Taysha公司的经历验证了这句话,成立不到一年就上市,后来因为管线临床效果不佳,股票大跌,如今又凭借TSHA-102起死回生。Taysha的技术平台是基于最近在基因治疗开发和商业化方面的成功——腺相关病毒血清型9(AAV9)衣壳,鞘内递送和高效的制造工艺。借由Taysha的案例,以及美国德克萨斯西南医学中心的科研人员发表的综述,本文对CNS疾病AAV载体基因疗法的开发现状与挑战进行讨论。

图1:美国德克萨斯西南医学中心的科研人员发表的综述 来源:elsevier官网
Taysha产品管线和TSHA-102
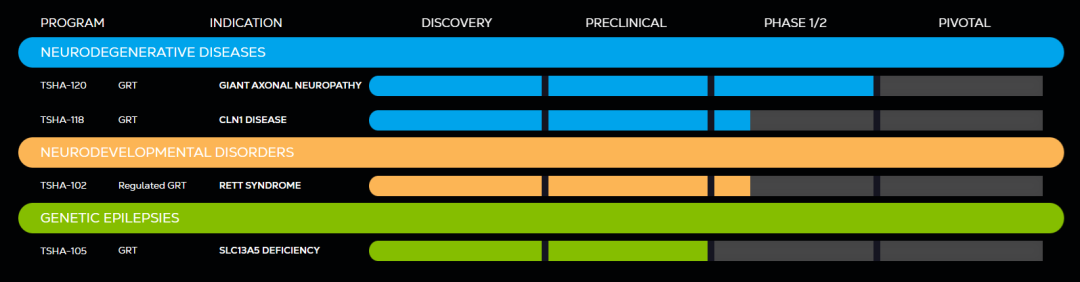
图2:Taysha目前管线全部针对CNS单基因遗传病 来源:Taysha官网
TSHA-102是一款基于Taysha专有新型miRNA响应性自动调节元件(miRARE)平台研发出的基因疗法,目的是增加中枢神经系统MECP2水平,并且没有过表达的风险。TSHA-102已获得FDA的孤儿药和罕见儿科疾病指定和欧盟委员会的孤儿药指定,向英国药监局MHRA提交了临床试验申请(CTA)。TSHA-102通过鞘内递送,以AAV9作为递送载体,正在一项首次开放标签、随机剂量递增和扩展REVEAL 1/2期临床试验中评估治疗Rett综合征的效果。REVEAL 1/2期试验正在加拿大蒙特利尔大学母婴大学医院中心CHU Sainte-Justine进行,Taysha已公布第一位RETT综合征成人患者的初始临床数据,经过六周的评估,TSHA-102 耐受性良好,没有治疗中出现的严重不良事件 (SAE),并且关键疗效指标有所改善。Rett综合征是一种由X连锁MECP2基因突变引起的罕见遗传神经发育障碍,该疾病的表现是智力残疾、沟通丧失、癫痫发作、发育减慢和/或退化、运动和呼吸障碍以及预期寿命缩短。据估计,TSHA-102能帮助美国、欧盟和英国约有15000至20000名患者。
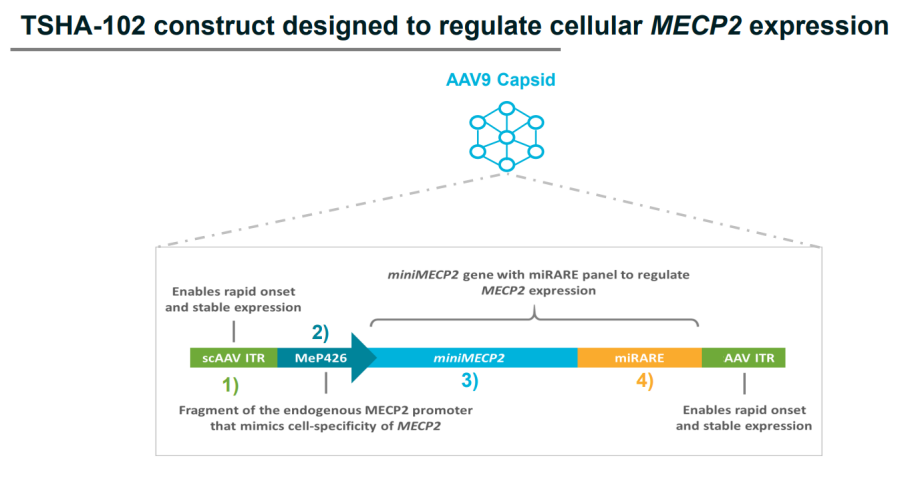
图3:TSHA-102结构设计 来源:Clinical gene therapy development for the central nervous system:Candidates and challenges for AAVs
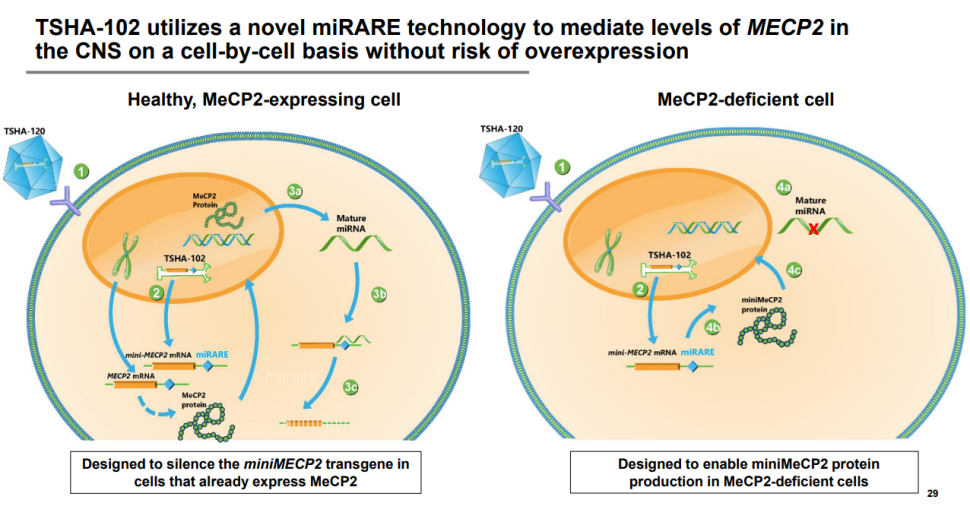
图4:TSHA-102作用机制 来源:Clinical gene therapy development for the central nervous system:Candidates and challenges for AAVs
Elsa Rossignol医学博士,蒙特利尔大学附属CHU Sainte-Justine神经科学和儿科副教授,REVEAL试验的首席研究员补充说:“在第一位患有Rett综合征晚期的成年人中,用TSHA-102治疗后观察到的疗效反应很有希望。在治疗之前,患者一直处于肌张力亢进状态,身体运动受限,需要持续的背部支撑,并且在儿童早期失去了精细和粗大运动功能。治疗后,我们观察到呼吸模式、发声和运动技能有所改善。十多年来,患者第一次能够独立坐着,并且自婴儿期以来首次展示了解开双手并稳定握住物体的能力。我相信,患者在治疗早期达到这些里程碑,加上我们观察到的呼吸模式和睡眠质量的改善,是非常令人鼓舞的,并支持TSHA-102的潜力。我很荣幸能与Rett综合征的合作研究中,帮助患有这种毁灭性疾病的患者和家庭。”
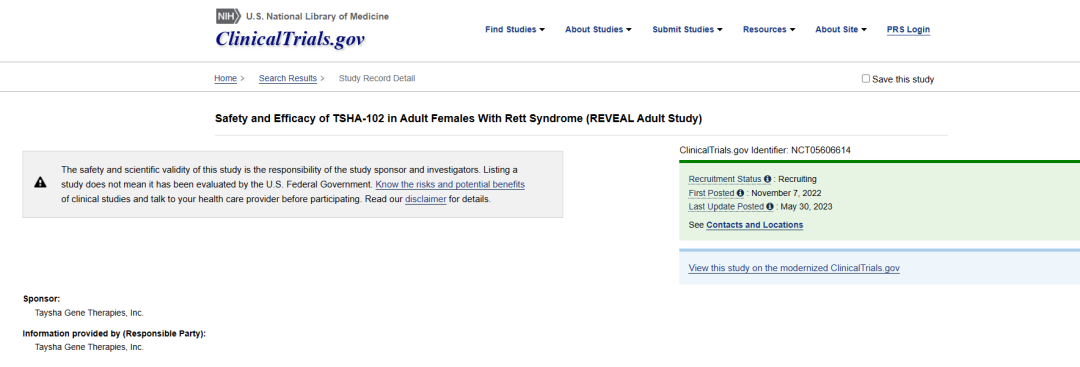
图5:REVEAL试验 来源:ClinicalTrials.gov
许多中枢神经系统(CNS)疾病都是遗传因素导致神经功能发生缺陷,传统的药物治疗可以带来短暂的治疗效果,但治标不治本。相比之下,基因治疗将核酸递送至宿主细胞,可以纠正基因突变并调节宿主蛋白表达,带来持久甚至治愈的效果。基因编辑技术的最新进展,包括DNA/RNA靶向、转录控制、碱基和引物编辑,为纠正基因突变疾病创造了前所未有的机会,所以说,基因治疗简直就是CNS单基因遗传病的“天选疗法”。
CNS疾病治疗的挑战——血脑屏障
基因治疗CNS疾病的一个主要挑战是克服血脑屏障(BBB)或血脊髓屏障(BSCB),即血管和中枢神经系统实质之间的物理屏障,这两种屏障分别表达重要的紧密连接蛋白,如claudin-5和claudin-11,这些蛋白可以维持屏障连接完整性和分子排他性。BBB和BSCB分别抑制从血液到脑和脊髓的分子运输,BBB阻断了大约98%的小分子药物和几乎所有的大分子药物进入脑组织,极大地阻碍了大多数中枢神经系统疗法。
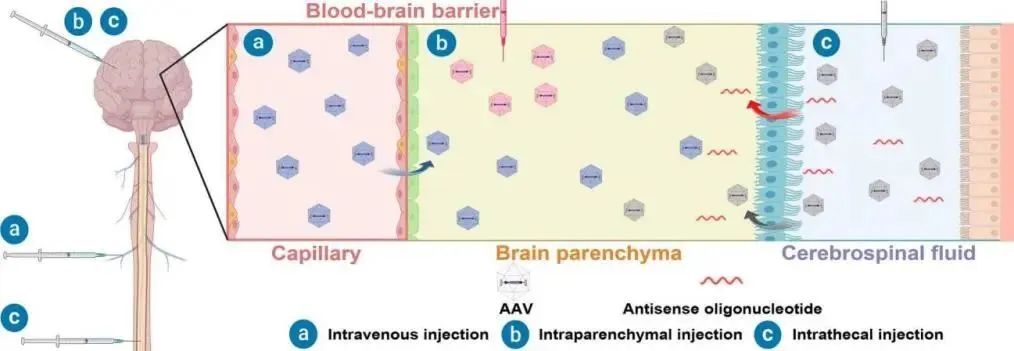
图6:血脑屏障示意图 来源:医麦客
鞘内注射时,药物可以经由脑脊液通过血管周围间隙的扩散或淋巴流动。然而,由于脑脊液从脑向血液的扩散和稀释,药物在脑内的积累可能会减少。同时,药物从脑脊液向脑的扩散与扩散距离的平方成反比。在灵长类动物侧脑室注射小分子药物时,在初始浓度仅为脑脊液浓度的1%时,药物积累呈对数递减。经脑室注射后,药物仅分布于脑室管膜表面。其他途径,如腰椎穿刺,尽管是最简单的给药途径之一,但在跨越障碍输送治疗药物方面效率也非常低下。在一项灵长类动物研究中,单次鞘内注射AAV9病毒载体或工程化的rAAV2杂交病毒可引起约2%的脑和脊髓细胞转导效率。FDA批准的临床试验中给药方式最常采用脑实质内、鞘内(进入脑脊液)和静脉注射。
人们通常错误地理解为药物打破血脑屏障的内皮屏障就可以直接进入脑实质,但实际上,药物还必须打破包含内皮糖萼、星形胶质细胞“末端-足底”和基底膜形成的的“三面屏障”。糖萼和星形胶质细胞在维持分子排他性方面都发挥着重要作用:星形胶质细胞形成“第二屏障”,称为胶质限制物;而糖萼维持血管完整性,由蛋白聚糖及其连接的糖胺聚糖(GAG)链组成,形成限制性机械和电荷基屏障。因此迫切需要能够有效跨越屏障并转导中枢神经系统的rAAV变体。
基因疗法适合罕见单基因遗传CNS疾病
作者在综述里面总结了遗传性中枢神经系统疾病的概述,以确定行使基因治疗的可行性CNS疾病范围。在这32种疾病中有17种是罕见的和单基因遗传病,全球发病率大多低于0.001%,并且许多是高致命性的。
CNS疾病在中枢神经系统中的位置会影响治疗策略。一些疾病效应局限于特定的中枢神经系统结构,而另一些则弥漫性地分布于整个中枢神经系统。例如,运动神经元疾病,如肌萎缩性侧索硬化症(ALS)和脊髓性肌萎缩症(SMA),通常是由脊髓内细胞的突变引起的;而溶酶体储存疾病,如神经节脂质中毒,则影响整个中枢神经系统。
目前FDA批准的用于CNS基因疗法使用非病毒或裸RNA递送。rAAV是CNS基因治疗的首选,因为rAAV衣壳能够更有效地穿过BBB,并且其递送的DNA整合到宿主基因组的可能性低,毒性低。AAV依赖于细胞膜受体的摄取,由于rAAV衣壳结构的变化,不同的受体和细胞类型摄取不同的血清型。例如,rAAV9衣壳主要与半乳糖受体结合;AAVrh.10主要结合硫酸n -乙酰乳胺(LacNAc);AAV2主要定位于硫酸肝素受体,其次定位于整合素、层粘连蛋白和成纤维细胞生长因子受体。通过剪裁衣壳和转基因以分别实现更特异的靶向和表达,中枢神经系统的定位可能进一步增强。基于rAAV9型科学家改造出两个新型AAV血清型:rAAV-PHP.eB和rAAV-PHP.S,分别对中枢神经系统和外周神经系统具有更好的嗜性。这些进展已经引起了业界针对没有充分治疗或治愈的挑战性CNS疾病开展临床前和临床研究的兴趣。
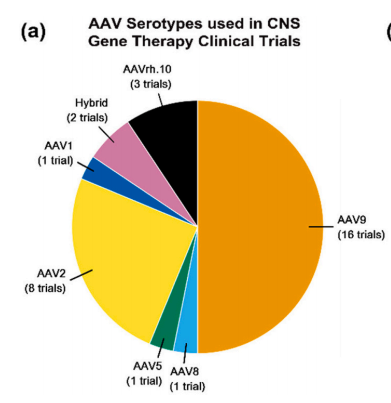
图7:临床试验使用穿透血脑屏障的rAAV血清型 来源:医麦客
但rAAV9的转运和转导效率可能不够高,必须以超过1014vg/ kg的高剂量给药才能转导20%的神经元。Zolgensma基因疗法已被批准用于治疗脊髓性肌萎缩症(SMA),但由于转导效率不高,需要1.1 × 10^14vg/kg的高剂量。如此高的剂量可导致肝脏和背根神经节的毒性。基因疗法的其他风险包括多次注射后的免疫反应和转基因永久整合到人类基因组中,特别是在肝脏中。早在2018年,就有相关研究指出,AAV载体对肝脏具有高亲和力,会天然富集在肝脏细胞中。这一事实导致,若只是靶向肝脏,低剂量的AAV载体即可有效,但若是靶向其他脏器,为了达到有效浓度,全身给药时AAV载体剂量必须大幅度提升,患者的肝脏负担非常重。
尽管rAAV具有明显的优势,但一些临床前CNS基因治疗使用的非病毒载体具有更好的体内隐身能力,易于修饰,可能不会引发免疫反应,并且具有更高的基因容量。然而,目前非病毒载体在中枢神经系统领域的进展有限,可能是由于与病毒载体相比,它们的转染效率较低,尽管进一步的临床前研究正在进行中,以提高转染率。
另外,治疗也可以由携带能力更大的不同病毒递送,如慢病毒、逆转录病毒或腺病毒。然而,这些其他的病毒选择可能会诱导显著的免疫反应或在基因整合到宿主基因组后引起插入突变,引起安全性方面的担忧。也有研究在探索天然递送载体,如外泌体。
CNS基因治疗的临床发展现状
FDA已经批准了多款CNS疾病基因疗法,其中包括DNA和RNA治疗。前者将目标基因插入载体并递送到靶组织,以更持久的一次性治疗恢复蛋白质功能。后者通过调节宿主RNA和蛋白质的产生来影响治疗结果。RNA治疗没有修饰宿主DNA的风险,更具安全性优势,但需要多次注射,反义寡核苷酸(ASOs)从每两周到每四个月不等,短干扰RNA (siRNA)每三周注射一次。
2017年,FDA批准了美国首款基于AAV载体(AAV2)的基因疗法Luxturna,用于治疗双等位基因RPE65突变相关的视网膜营养不良的眼科疾病。这是真正意义上的FDA首次批准用于治疗遗传性疾病的基因疗法。与后续其他基因疗法一样,Luxturna定价同样昂贵,单眼治疗费用高达42.5万美元。
但若论全球首款AAV基因疗法,则还要再向前追溯。2012年,EMA批准了基于AAV1载体的基因疗法Glybera,通过向患者骨骼肌递送脂蛋白脂肪酶基因,从而降低患者胰腺炎的发病率。一针百万的定价,加上过于狭窄的罕见病市场,Glybera最终于2017年黯然退市离场。
第三款则是来自诺华的Zolgensma,用于治疗脊髓性肌萎缩症(SMA),使用AAV9递送活性运动神经元存活基因1(SMN1)以取代无功能的突变SMN1,于2019年获批,定价212.5万美元。2022年8月,诺华报告两名儿童在接受Zolgensma治疗后,因急性肝功能衰竭而死亡。截至报告之际,全球范围内已有超过2300名患者接受了Zolgensma治疗——这是该药上市以来,首次报告急性肝衰竭的死亡病例。
目前,有24项正在进行的临床试验使用穿透血脑屏障的rAAV血清型(即rAAV9和AAVrh.10)治疗中枢神经系统,其中就包括Taysha的治疗婴儿GM2神经节苷脂沉积症的TSHA-101(NCT04798235)和治疗巨轴索神经病变(GAN)的TSHA-120(NCT02362438)。接受TSHA-101治疗的第一个患者不幸死亡,虽然这次死亡被认定与基因疗法无关,可能与免疫抑制方案有关,但这个死亡案例仍然给TSHA-101带来了不小的负面影响。这也是Taysha公司之前裁员,股价下跌的原因之一。
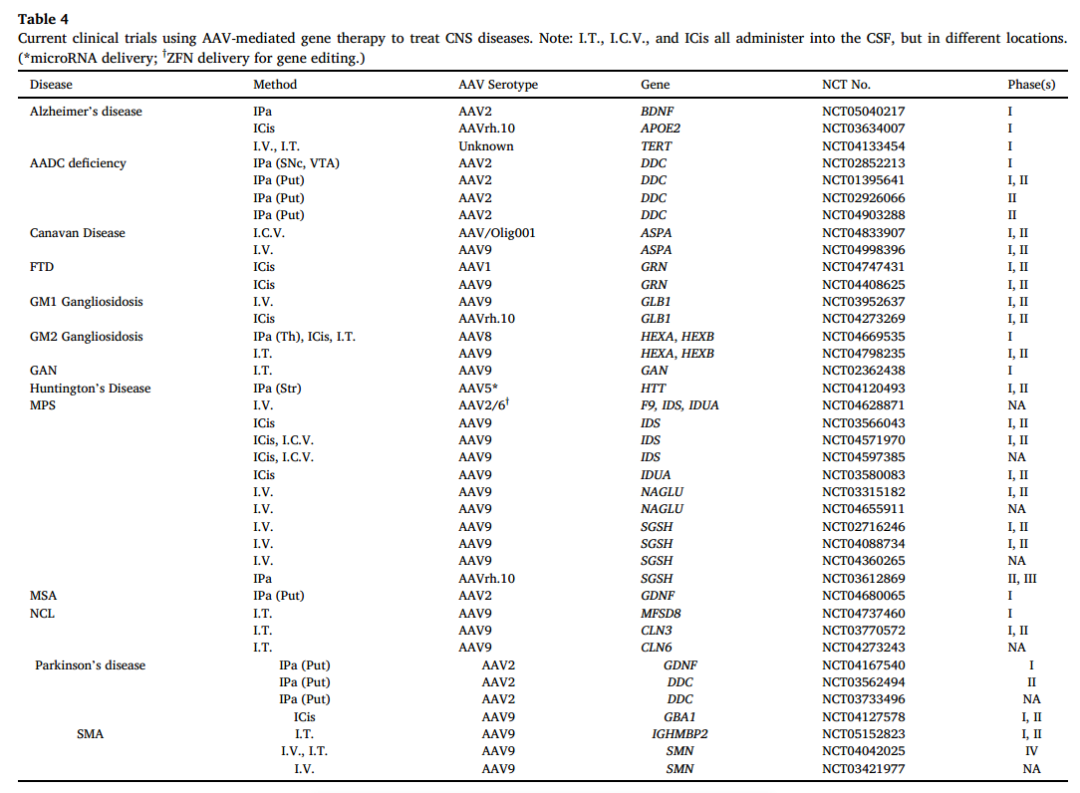
图8:正在进行的临床试验使用穿透血脑屏障的rAAV血清型统计 来源:AAV capsid variants with brain-wide transgene expression and decreased liver targeting after intravenous delivery in mouse and marmoset
值得一提的是,8月23日,中南大学湘雅医院官网发布新闻,由神经内科主任、国家老年疾病临床医学研究中心(湘雅)副主任沈璐教授牵头的“BBM-P002注射液颅内注射治疗中晚期帕金森病的单臂、开放性、单中心、小样本探索性临床研究”顺利启动并完成首例受试者的初步随访,这是国内首个在帕金森病患者中开展的基因治疗临床研究。首例受试者于2023年6月1日在神经外科成功完成给药;治疗后4周,受试者的肌张力、睡眠情况、口服药物时效均有所改善;影像学报告显示研究药物注射部位准确,双侧纹状体基因表达产物活性增强。目前,该受试者已处于治疗后12周,整体状态良好,各项指标维持改善,生活质量较前有所提高,长期安全性和有效性仍在随访观察中。
总结
基因疗法在治疗单基因遗传疾病领域具有独特优势,行业目前还处于前期探索阶段,在未来还需要解决安全风险,肝脏毒性,减少脱靶率,开发新的载体,提高递送效率等问题。靶向中枢神经系统疾病的基因疗法更是极具开拓性与挑战性,在常规挑战之外,增加了克服血脑屏障的难题,业界未来还需开发中枢神经噬性更强的rAAV载体。
参考资料:
1.https://doi.org/10.1016/j.jconrel.2023.04.009
2.https://www.businesswire.com/news/home/20230821344818/en/
3.https://tayshagtx.com
4.https://doi.org/10.1007/s13311-014-0299-5
5.https://www.xiangya.com.cn/list/2299/66339.html