近日,针对全身性重症肌无力的利好消息频出。首先,FDA批准优时比(UCB)的Rystiggo(rozanolixizumab)的上市申请,用于治疗全身性重症肌无力(gMG)成人患者;
其次在国内,石药与和铂共同开发的巴托利单抗注射液的新药上市申请获CDE受理,拟用于gMG。
|关于Rozanolixizumab
Rozanolixizumab是一种皮下注射的人源化单克隆抗体,以高亲和力特异性结合人类新生儿 Fc 受体 (FcRn);通过阻断FcRn 和免疫球蛋白 G (IgG) 的相互作用,加速抗体的分解代谢并降低致病性 IgG 自身抗体的浓度。目前,该药物正开发治疗多种由致病性IgG自身抗体驱动的自身免疫性疾病,包括gMG、原发性免疫性血小板减少症、自身免疫性脑炎等。
Rozanolixizumab于2019与2020年分别获FDA与欧盟孤儿药资格认定,用以治疗重症肌无力。
2023年5月,根据发表于《柳叶刀·神经病学》杂志的数据,在一项随机、双盲、安慰剂平行对照、适应性两阶段设计的3期MycarinG试验中,患者确诊gMG,AChR或MuSK抗体阳性,且MG日常生活活动(MG-ADL)评分≥3(非眼部症状)、重症肌无力定量评分表(QMG)≥11、体重≥35 kg,共300例患者,接受rozanolixizumab治疗7 mg/kg或10 mg/kg或安慰剂,按每周一次皮下注射,治疗期为6周,随访观察期为8周。
患者经治后的症状改善以第43天相比基线变化衡量,主要终点指标为MG-ADL,次要终点指标为MGC、QMG、患者自主报告的结局(PRO)及MG-ADL;安全性终点为导致治疗中断的不良事件(TEAEs)。
结果显示:
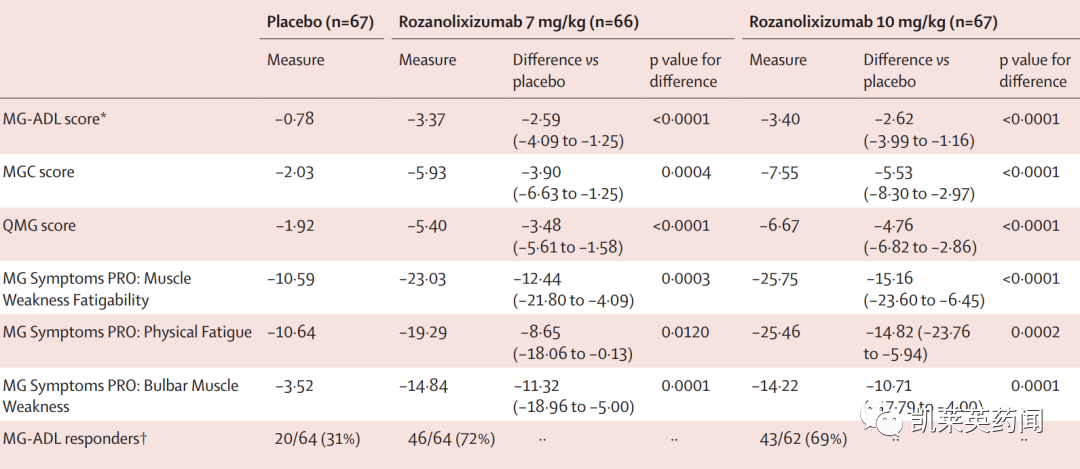
在治疗后的第43天,高、低剂量组均显现MG-ADL的大幅改善,相比基线变化值为–3.40与-3.37,安慰剂组为-0.78,且药物治疗组显著优于安慰剂组;
对MuSK抗体阳性gMG患者的亚组分析显示,高剂量组改善幅度为–4.16,低剂量组为-7.28,安慰剂组为2.28;
在治疗后的第43天,高、低剂量组在MGC、QMG分值及PRO的改善均显著优于安慰剂组;症状改善最早于治疗后的第8天显现,贯穿整个治疗期,直至第99天又恢复至基线水平。
MuSK抗体阳性gMG患者亚组显示,无论接受的是高剂量或低剂量药物,全部都获得MG-ADL明显改善(改善幅度≥2分),而安慰剂组仅14%(1/7)的患者达到这一改善幅度;以经治后达到最轻症状的患者比率看,高剂量组为28%,低剂量组为26%,安慰剂组为3%。
总IgG水平的大幅下降出现在治疗后的第8天,然后第99天恢复至基线水平。
在安全性上,任何TEAEs或药物相关TEAEs的发生率均很低,且与安慰剂组相近;高剂量组因TEAEs导致治疗中断的发生率略高,症状包括腹泻、上腹痛、呕吐、口腔疱疹、转移性鳞状细胞癌、瘙痒症和深静脉血栓形成。研究期间未出现死亡、严重超敏反应及自杀倾向的患者,患者对药物皮下注射的耐受性良好。
研究表明,一天一次皮下注射7 mg/kg或10 mg/kg均显著、稳定地改善了患者症状,且安全耐受性良好;此外,MuSK抗体阳性gMG患者获得更佳的病情控制,并在第43天均显示MG-ADL明显改善;给药后第8天,rozanolixizumab能够快速降低患者血液IgG水平,被认为与疗效终点改善相关。
|关于巴托利单抗
巴托利单抗(HBM9161,batoclimab)同样是一款靶向FcRn的全人源单克隆抗体,可阻断FcRn-IgG相互结合,加速体内IgG的清除,从而达到有效治疗致病性IgG介导的自身免疫性疾病的效果。早期研究表明,巴托利单抗具有良好耐受性,可迅速降低多种自身免疫疾病患者体内IgG水平。
该药物于2021年初获得中国国家药品监督管理局授予的“突破性治疗认证”,并于同年8月完成针对中国全身型重症肌无力患者的概念验证研究。
2017年9月,和铂与HanAll签署战略合作协议,获得了巴托利单抗在大中华地区,包括中国大陆、香港、澳门和台湾开发的授权。
2022年10月,和铂医药与石药集团全资子公司恩必普药业达成协议,在大中华区共同开发巴托利单抗。恩必普药业获得在大中华区(包括中国大陆、香港、澳门及台湾)开发、生产与商业化巴托利单抗的独家授权;和铂医药负责巴托利单抗在中国针对全身型重症肌无力的全完整临床实验的设计与执行, 并根据产品年度净销售额获得分层销售提成。
2023年6月,公司宣布巴托利单抗治疗gMG的III期临床试验取得积极研究结果,符合主要研究终点及关键次要研究终点;同时,其治疗总体上安全且耐受性良好,未发现新的安全性信号。
一项在中国全身型重症肌无力患者开展的II期研究,用于评估巴托利单抗的安全性和有效性;该试验共入组30例患者,主要终点是从基线起43天时MG-ADL的评分变化,降低2分或以上为改善;次要终点包括从基线起第43天时QMGs(降低3分及以上为改善)、MGC、MG-QoL15r评分的变化。
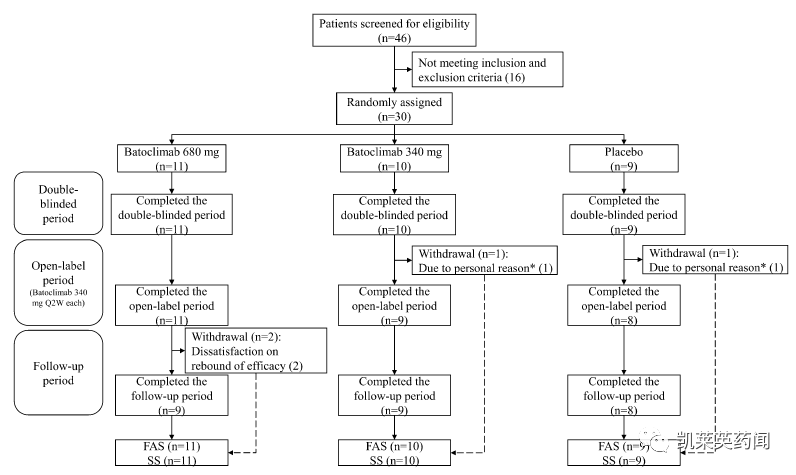
结果显示:
到治疗43天时,安慰剂组、340mg和680mg治疗组的MG-ADL评分变化依次为-2.2、-4.7、-4.4;QMGs变化依次为-1.7、-8.0和-8.8。
合并两个batoclimab治疗组,以MG-ADL评分改善率高达85.7%,显著高于对照组55.6%;QMGs改善率高达95.2%,显著高于对照组44.4%。
治疗第一周,340mg和680mg治疗组的总血清IgG水平分别降低了23%和44%,而安慰剂组仅为1%;到第43天时, 340mg和680mg治疗组的总血清IgG水平分别降低了57%和74%,而安慰剂组为2%。
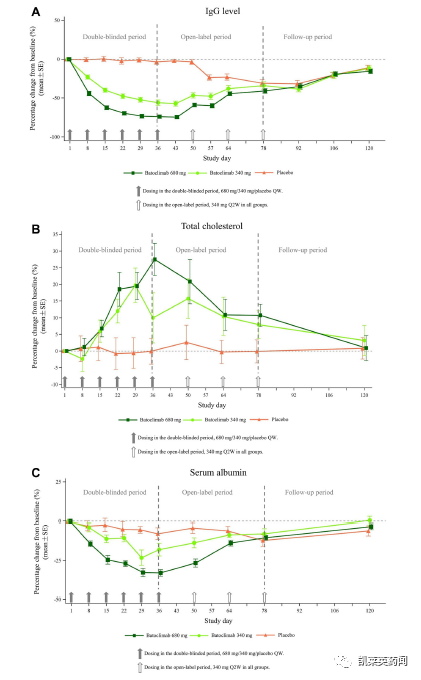
此外,药物安全性和耐受性良好;没有患者死亡、出现严重不良事件。常见的不良事件是高胆固醇血症、低钠血症、尿路感染、注射部位反应和外周水肿等。
|关于FcRn药物
FcRn 又称Brambell受体,是一种由Fcgrt 基因编码的非典型的Fcγ 受体(FcγRs)。FcγRs 对IgG 的识别代表了一种重要的免疫调节方式,即能够不IgG 上保守的Fc 结构域相结合,再以IgG免疫复合物(IgG IC)的形式递送独特的抗原决定簇。这些抗原决定簇被装载到I 类和II 类MHC 分子上,随后刺激相关CD8+和CD4+ T 细胞。IgG主要由脾脏以及淋巴结中的浆细胞合成和分泌,常以单体形式存在,是血清中最主要的抗体成分。在大多数体液免疫过程中,无论是针对病毒还是细胞病原体的保护作用也都涉及IgG 所介导的效应子功能。IgG能够清除侵入人体的外源异物,FcRn则在人体内用于维持IgG水平,增长IgG抗体半衰期,减缓IgG在溶酶体中的降解速度。
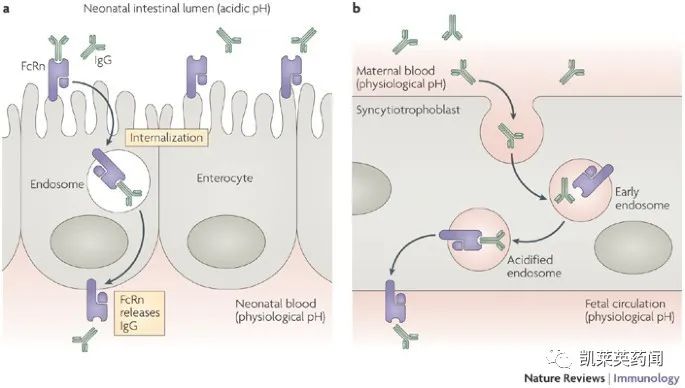
研究表明,FcRn 广泛表达于各个组织的细胞中,其中包括与血管壁对齐的内皮细胞,肠上皮细胞、气道上皮细胞、胎盘合胞体滋养细胞、肝细胞、内皮细胞、髓样细胞以及支气管导管细胞等;此外,在造血细胞如B 细胞、巨噬细胞以及树突状细胞中也収现了高水平表达的FcRn,理论上可导致七八十种自身免疫性疾病。由FcRn 介导的抗原递呈过程不能影响各个部位的稳态免疫激活,是内源抗肿瘤活性及肿瘤免疫监视系统中的重要组成部分,该过程已被广泛认可的CD8+ T 细胞能够抗肿瘤方面的重要性相一致, 因此FcRn 介导的交叉递呈也能够启动肿瘤保护的机制。
据不完全统计,目前在研的FcRn药物约10种,具体信息总结如下:
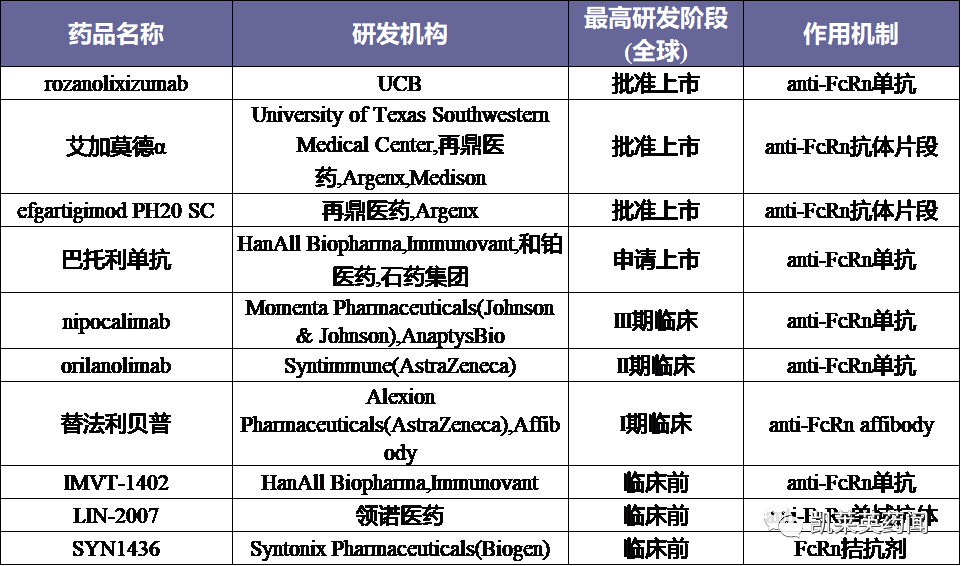
|关于全身性重症肌无力
重症肌无力(MG)是一种神经肌肉疾病,由针对突触后膜上乙酰胆碱受体、肌肉特异性激酶或其他乙酰胆碱受体相关蛋白的自身抗体引起。患者常有眼肌表现,约85%的患者会出现眼肌以外的症状,发展为全身型重症肌无力(gMG),甚至发生肌无力危象。作为一种罕见的、慢性自身免疫性疾病,MG由神经-肌肉接头传递功能障碍引起,病程长、难治愈、易复发,2018 年已被纳入我国《第一批罕见病目录》。
据文献统计,全球重症肌无力的年发病率并不高,数值仅为0.3/10 万—2.8/10万,但由于重症肌无力是一种慢性病,真实患者群体规模需累加计算,实际上,全球重症肌无力实际患病率大约为10/10 万,基于这一数字保守测算,全球重症肌无力患者至少超70 万人。
国内发病率虽然看似较低,只有0.68/10 万,女性发病率略高,但实际总患者规模大约有20 万。住院死亡率为14.69‰,主要死亡原因包括呼吸衰竭、肺部感染等。各个年龄阶段均可发病,30 岁和50 岁左右呈现发病双峰,中国儿童及青少年MG(JMG)患病高达50%,构成第3 个发病高峰;JMG 以眼肌型为主,很少向全身型转化。最新流行病学调查显示,我国70-74 岁年龄组为高发人群。并且,未来这一数字可能会持续增长。
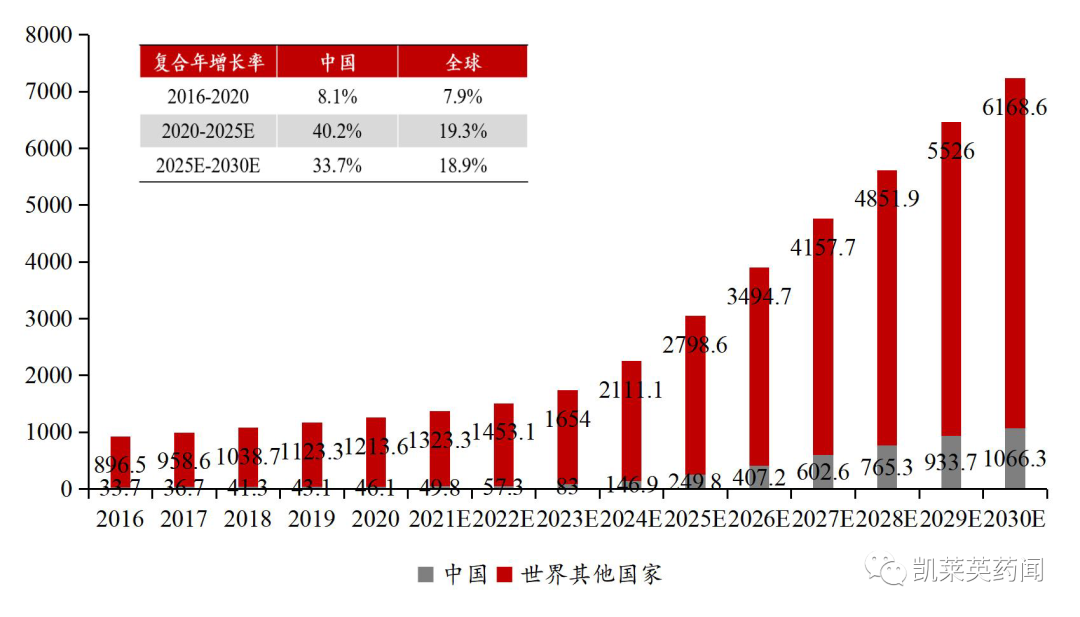
全球及中国重症肌无力治疗药物市场预计持续快速增长,根据弗若斯特沙利文测算,全球MG 治疗药物市场将从2020 年的12.6 亿美元增至2025年的30.48 亿美元,CAGR 达19.3%,中国市场则是从0.46 亿美元增至2.5 亿美元,CAGR 达40.2%。
全球及中国重症肌无力药物市场规模逐年增长(百万美元)
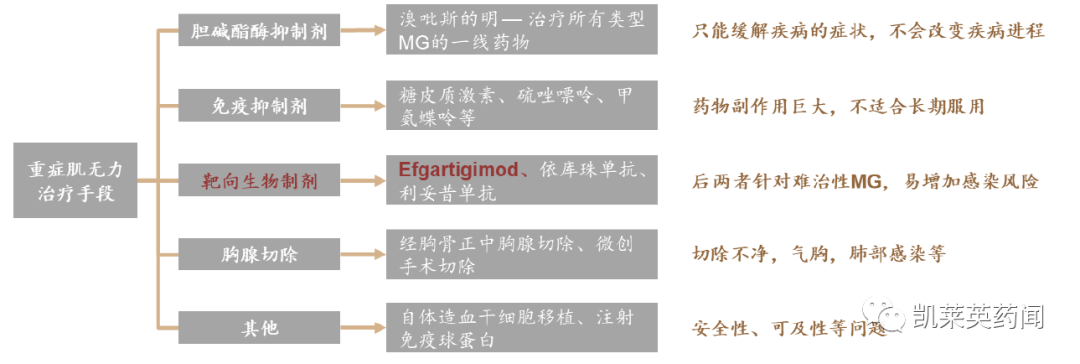
当前,重症肌无力最常见的治疗方案包括乙酰胆碱酯酶抑制剂、免疫抑制剂、靶向生物制剂、静脉注射免疫球蛋白、血浆置换以及胸腺切除等。
1)乙酰胆碱酯酶抑制剂是治疗重症肌无力的一线药物,最常用的是溴吡斯的明,不过这类药物只能缓解疾病的症状,不会改变疾病进程;且通常需要与其他药物(如免疫抑制剂)联合用于治疗重症MG。
2)免疫抑制药物包括糖皮质激素和其他口服非激素类免疫抑制剂,如硫唑嘌呤、他克莫司、环孢素、甲氨蝶呤、泼尼松及甲泼尼龙等,这类药物副作用巨大,不适合长期服用。
3)靶向生物制剂方面,在efgartigimod之前,被FDA 批准用于治疗MG 的有靶向抑制C5 补体的依库珠单抗(eculizumab),除此之外,还有适应证外用药的靶向B 细胞的利妥昔单抗(rituximab)。不过两者都是针对难治性MG,而且依库珠单抗价格昂贵,容易增加脑膜炎奈瑟菌感染风险,因此适用人群非常有限。
4)其他挽救性治疗手段如胸腺切除术、静脉注射免疫球蛋白、血浆置换等,也存在安全性、可及性等问题。
重症肌无力治疗手段与限制
参考资料
1、各公司官网
2、Bril V, et al. Safety and efficacy of rozanolixizumab in patients with generalised myasthenia gravis (MycarinG): a randomised, double-blind, placebo-controlled, adaptive phase 3 study. Lancet Neurol. 2023 May;22(5):383-394.
3、Yan C, Duan R S, Yang H, et al. Therapeutic effects of batoclimab in Chinese patients with generalized myasthenia gravis: a double-blinded, randomized, placebo-controlled phase II study[J]. Neurology and Therapy, 2022, 11(2): 815-834.
4、Chen J, Tian D C, Zhang C, et al. Incidence, mortality, and economic burden of myasthenia gravis in China: a nationwide population-based study[J]. The Lancet Regional Health-Western Pacific, 2020, 5: 100063.
5、德邦证券、东亚前海证券
6、公众号:征战重症肌无力、罕见病新进展