五十年来,基因治疗的神话不断被畅想。美国时间2023年6月22日,Sarepta公司宣布,ELEVIDYS作为全球首款杜氏肌营养不良(DMD)的一次性基因疗法获得美国FDA批准上市,用于治疗 4-5 岁可独立行走的DMD儿童,再创历史性里程碑。
DMD是常见的X连锁隐性遗传性肌肉变性疾病,在男性新生儿中的发病率约为1/3500。通过基因检测,93.1%的患者具有遗传学病因,为早期的基因治疗奠定基础。DMD的致病基因为抗肌萎缩蛋白基因,位于染色体Xp21.2区,全长约2.2Mb,共包含79个外显子,是已知最大的人类基因;它们负责制造抗肌萎缩蛋白(dystrophin),而这是一种对肌肉细胞健康必不可少的蛋白质。DMD基因突变以外显子缺失/重复为主,基因内部外显子及侧翼区域的点突变次之。由于基因突变,患者肌肉组织缺少抗肌萎缩蛋白,致使肌肉无力并渐进性肌肉损失。大多数患儿在12岁时都无法行走,并会在30岁左右死亡。
1、ELEVIDYS疗法概况
Sarepta是一家商业阶段的生物制药公司,致力于发现和开发治疗罕见疾病的疗法。目前公司已有三款针对DMD的反义寡核苷酸药物获批上市(EXONDYS 51、VYONDYS53、AMONDYS45)。ELEVIDYS的研发代号为SRP-9001,旨在通过在肌肉组织中定向产生抗肌萎缩蛋白的功能成分来解决DMD的根本原因;将截短了的抗肌萎缩蛋白(迷你DMD)的转基因包装在AAV病毒载体中,单次静脉注射使得患者肌肉生成具有部分抗肌萎缩蛋白功能的重组蛋白,可以对携带任何类型DMD致病基因变异的患者生效(图1)。与大多数基因疗法存在一个区别,因为超大尺寸的DMD基因无法容纳在常规的基因治疗病毒中,微型版本的基因克服了这一问题。尽管缺失了完整的DMD基因,因为核心成分仍然存在,几乎可以发挥与完整基因相同的作用。
图1. ELEVIDYS疗法示意图 ELEVIDYS此前已获得FDA快速通道认定,在美国获得了罕见儿科疾病(RPD)认定,在美国、欧盟、瑞士和日本获得了孤儿药认定(ODD)。以下为药物说明书的部分信息。 单剂量静脉注射一次性治疗,推荐剂量为1.33 ×1014基因组拷贝总数(vg) / kg,以<10 mL/kg/小时的速率于1-2内完成注射。 禁用于 DMD 基因中外显子8和/或外显子9缺失的患者;接受治疗者需符合抗AAVrh74 总结合抗体滴度<1:400,无感染发生或感染痊愈,肝功能、血小板、肌钙蛋白I均正常。 建议患者在 ELEVIDYS 输注前后进行全身皮质类固醇治疗;当有需要时调整皮质类固醇治疗方案。如果怀疑急性严重肝损伤,建议咨询专家。 免疫介导的肌炎。在临床试验中,在DMD 基因中涉及外显子8和/或外显子9的缺失突变患者中,在ELEVIDYS 输注后约1个月观察到免疫介导的肌炎。观察到严重肌无力的症状,包括吞咽困难、呼吸困难和发声减退。 对于DMD基因在外显子1 至17和外显子59 至71之间存在突变的患者,ELEVIDYS 治疗的可用数据有限。这些区域缺失的患者可能面临严重免疫介导性肌炎反应的风险。 不良反应。临床研究中报告的最常见不良反应(发生率≥5%)是呕吐、恶心、肝功能检查升高、发热和血小板减少。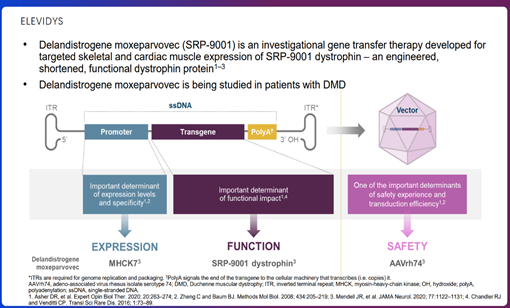
2、临床试验概况
ELEVIDYS的加速批准是基于骨骼肌中微型肌营养不良蛋白表达的增加。一般的新药申报上市,都需要一期二期和三期临床试验的结果出来后才申报。SRP-9001因为是儿科罕见病用药,走的是快速审评通道,在二期临床试验的结果出来后,就率先申报。至今为止,SRP-9001已经积累了182.75患者年,其中最长的一个患者使用后5年的数据。Sarepta所提交的生物制品许可申请(BLA)包括3项临床研究的疗效和安全性数据(图2):I/II期SRP-9001-101、II期SRP-9001-102和III期SRP-9001-103(也称为ENDEAVOR),以及这3项临床研究的综合分析,比较了功能结果与倾向性评分匹配的外部对照(EC)。
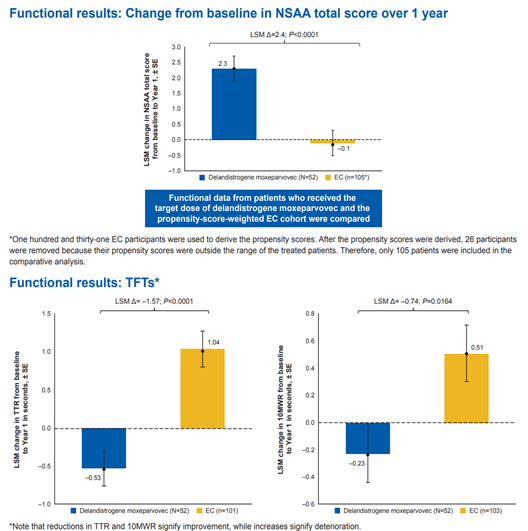
图2. 评估SRP-9001的临床试验 SRP-9001-101是项单中心开放标签临床试验,以评估SRP-9001材料的单剂量临床过程的安全性、耐受性和概念证明。随访时长已达四年,接受治疗的受试者(n=4,治疗时年龄为4-7岁)的NSAA评分在治疗前后提高了7分。目前这些受试者都已平安长大,平均年龄超过9岁。 SRP-9001-102是双盲、1:1随机、安慰剂对照临床试验,纳入41名4-7岁DMD患者。包括两个主要终点,12周时微肌营养不良蛋白的表达和48周时与对照组相比NSAA总评分的变化。 SRP-9001-103是项开放标签临床试验,纳入了38例DMD患者,其中20例参与者年龄为4 ~ 7岁,治疗1年后,患者的运动能力显著改善,NSAA评价表中表现出3.8分,用最小二乘法调整后为3.2分,差异均具有统计学意义(P=0.0001)。 对三项研究一年功能数据的综合分析显示(图3),接受SRP-9001治疗的患者的NSAA总评分在治疗前后提高了3.1分,经最小二乘法调整后为2.3分。与对照组相比,治疗组的NSAA总评分提高了2.4分(P=0.001)。 图3. 对三项研究一年功能数据的综合分析 ELEVIDYS的三期临床试验SRP-9001-301(也称为EMBARK)还在进行,这是一项全球性、随机双盲、安慰剂对照研究,招募了125名患者。主要终点将评估与安慰剂组相比,患者52周的NSAA总分评估。EMBARK的主要特点包括按年龄和NSAA评分对受试者进行分类,至少有50%的4至5岁患者参加。纳入标准包括在筛选前至少12周稳定每日口服剂量皮质类固醇和小于1:400的rAAVrh74抗体滴度。预计这项试验结果将会在今年晚些时候公布,而FDA可能根据此试验数据考虑扩大药物的使用范围,使其能够被用于6-7岁DMD患者的治疗。 近日,Sarepta官网还发布了SRP-9001-303(ENVISION)临床试验在美国启动患者招募,将以72周的双盲、安慰剂对照试验,评估SRP-9001对可独立行走或卧床的DMD大龄患者的疗效与安全性,以支持未来该新疗法适应症人群的扩展。可见,Sarepta对DMD治疗怀有远大抱负,满怀信心地全力推进ELEVIDYS在全球的开发和制造;针对ELEVIDYS在全球的布局,2019年12月 Sarepta 与罗氏达成的合作,美国以外患者获得ELEVIDYS治疗亦有望快速实现。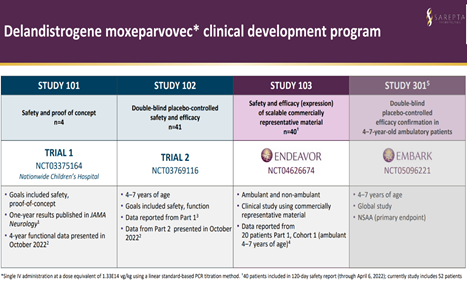
参考文献:
1.https://www.elevidys.com/
2.https://mp.weixin.qq.com/s/niNiS_Y-7hTLJbTCVsX1AQ