2023年6月5日,根据中国国家药监局药品审评中心(CDE)官网公示,诺华制药的补体B因子Iptacopan(伊普可泮)治疗阵发性睡眠性血红蛋白尿症(PNH),拟纳入优先审评程序。此前曾被CDE纳入突破性治疗品种,用于治疗PNH。
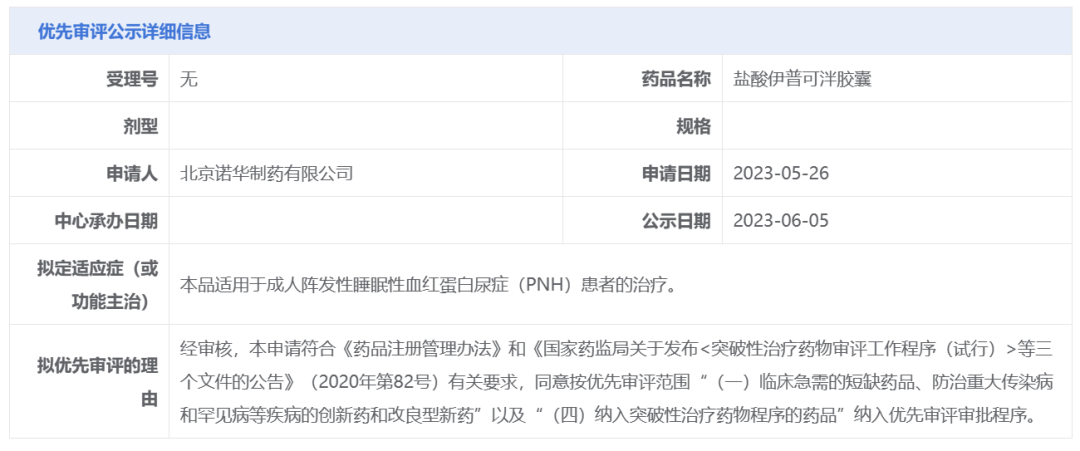
CDE官网显示,盐酸伊普可泮胶囊拟纳入优先审评的理由为:“(一)临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药”以及“(四)纳入突破性治疗药物程序的药品”。
阵发性睡眠性血红蛋白尿症 (PNH) 是一种补体介导的慢性罕见血液疾病。PNH 患者的造血干细胞 PIG-A 基因发生突变,导致其产生易于被补体系统过早破坏的红细胞。从而引发血管内溶血 (红细胞在血管内被破坏) 和血管外溶血 (红细胞在脾脏和肝脏中被破坏),临床主要表现为贫血、阵发性血红蛋白尿、骨髓造血功能衰竭和血栓形成等。
PNH 是一种严重影响患者生活质量的罕见病。据统计,发病率约百万分之一到二,亚洲人群发病率高于欧美。PNH 可在任何年龄发生,常见于 30-40 岁人群。2018年5月11日,中国国家卫生健康委员会等5部门联合制定了《第一批罕见病目录》,阵发性睡眠性血红蛋白尿症被收录。
Iptacopan是被纳入优先审评第二款治疗PNH药物,在去年8月,罗氏正式提交了Crovalimab的中国上市申请,并被纳入优先审评。
目前,全球监管机构已批准3款PNH药物,即Soliris(依库珠单抗,阿斯利康/Alexion)、Ultomiris(ravulizumab,阿斯利康/Alexion)和Empaveli (pegcetacoplan,Apellis公司),其中仅Soliris在国内获批上市。
此外,目前全球还有多款在研PNH新药。预计不久的将来,PNH领域将迎来更多治疗选择。