靶向抗肿瘤药获批治疗儿童神经纤维瘤。
国家药品监督管理局6月1日在网站上宣布,通过优先审评审批程序批准阿斯利康投资(中国)有限公司申报的硫酸氢司美替尼胶囊(商品名:科赛优®/ KOSELUGO®)上市,用于3岁及3岁以上伴有症状、无法手术的丛状神经纤维瘤(PN)的I型神经纤维瘤病(NF1)儿童患者。
神经纤维瘤是一种使人衰弱的遗传病,全世界每 3,000 人中就有一人受到影响。
1型神经纤维瘤病(NF1)是一种罕见常染色体显性遗传病,多在儿童期发病,出现进行性皮肤、神经、骨骼和肿瘤的表现。发生中枢和周围神经系统肿瘤的风险更高,其中丛状神经纤维瘤(PN)最为常见.
在 30-50% 的 NF1 患者中,因为肿瘤在神经鞘上发展(丛状神经纤维瘤),可能导致严重影响容貌又疼痛的各种临床问题,如:毁容、运动功能障碍、疼痛、气道功能障碍、视力障碍和膀胱或肠道功能障碍。
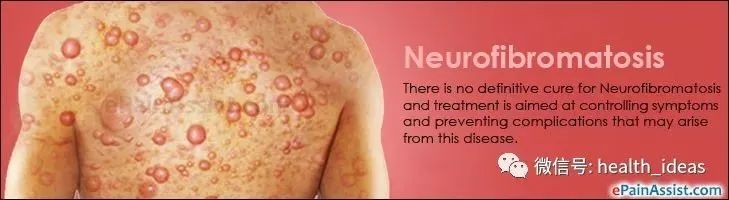
(NF神经纤维瘤毁容还痛苦)
“本品是全球首个获批用于该适应症的靶向药物,将为我国患者提供新的治疗选择。"
国家药品监督管理总局表示道。
NF没有列入此前颁布的国家第一批罕见病目录。
在一项名为Sprint的二期临床试验中,结果表明 ,司美替尼(上市名:Koselugo )减少了无法手术治疗的NF1型儿童的肿瘤的大小,减轻了疼痛,并提高了生活质量。
司美替尼是欧盟首次批准的治疗 NF1丛状神经纤维瘤(NF1-PN)的药物,这个批准是在2021年4月的人用药品委员会(CHMP)的积极建议后做出的。
司美替尼由阿斯利康 (AstraZeneca) 和默沙东 (MSD) 合作。在全球开发上市。
司美替尼是丝裂原活化蛋白激酶激酶 1 和 2 (MEK1/2) 的抑制剂。
MEK1/2 蛋白是细胞外信号相关激酶 (ERK) 通路的上游调节剂。该通路通常在不同类型的癌症中被激活。司美替尼于 2019 年 4 月获得美国 FDA 突破性疗法指定,2019年12月获得罕见儿科疾病指定,并于 2018 年2月获得美国孤儿药指定。
欧盟、日本、俄罗斯、瑞士、韩国、台湾和澳大利亚已授予孤儿药指定。
Sprint二期试验是由美国国立卫生研究院国家癌症研究所 (NCI) 癌症治疗评估计划 (CTEP) 赞助。
北海康城新药获批
北海康城(CANbridge)宣布,迈芮倍®(LIVMARLI®/氯马昔巴特口服溶液)已获得了中国国家药品监督管理局(NMPA)的批准上市,用于治疗1岁及以上阿拉杰里综合征(ALGS)患者胆汁淤积性瘙痒 。
此前,迈芮倍在美国获得批准上市,用于治疗3个月及以上ALGS患者的胆汁淤积性瘙痒;并在欧洲获得批准上市,用于治疗2个月及以上的患者。
在一份新闻稿中,北海康城表示,根据中国海南博鳌乐城国际医疗旅游先行区的“先行先试”政策,迈芮倍去年已被批准作为临床急需药品在该区内治疗ALGS。
Alagille综合征(ALGS)是一种常染色体显性遗传疾病,可导致晚期肝脏疾病和死亡。其发病率在1/30,000到1/50,000之间。
ALGS以胆管发育异常和外肝脏器官(如肾脏和眼睛)以及骨骼和心血管系统的受累为特征。100%的患者都有肝脏受累,通常在新生儿期或出生后的前3个月内表现为慢性胆汁淤积(胆汁流动减慢或停滞)。
除了黄疸、皮肤黄色瘤和肝肿大外,患者还会出现严重的瘙痒,这可能导致患儿搔抓而引起皮肤畸形、情绪障碍、睡眠剥夺和学习中断,并严重影响患者的生长、发育和生活质量,并可能导致肝移植, 公司表示。
"芮倍是中国唯一获批用于治疗与ALGS相关的胆汁淤积性瘙痒的药物。我们期待将这种具有前景的新疗法带给中国数千名ALGS患者,并进一步开发迈芮倍的其他适应症。"
北海康城董事长薛群博士表示道.
北海康成从Mirum公司获得了迈芮倍在大中华区开发和商业化以及在特定条件下生产的独家授权,用于治疗包括胆道闭锁(BA)、阿拉杰里综合症(ALGS)和进行性家族性肝内胆汁淤积症(PFIC)在内的三种罕见肝病以及其他可选择的适应症。
LIVMARLI目前正在进行用于治疗胆道闭锁BA的2期全球EMBARK研究。
新闻稿:
https://www.canbridgepharma.com/cn/media-news/press-release/20230602/