
摘要
目的:Silver-Russell综合征(SRS)会导致身材矮小,生长激素(GH)治疗旨在增加成年身高。然而,对经分子诊断的SRS患者的GH长期疗效数据仍相对较少。本研究评估了分子诊断的SRS患者的身高、体重指数(BMI)和GH治疗情况。
研究方法:对收集的数据进行一个回顾性观察性研究。
研究对象:≥13岁分子诊断的SRS患者。
数据收集:身高、身高增长(从童年到最终或接近成年身高的身高标准差分数(SDS)的变化)、BMI和BMI增长(从童年到成年)以及既往GH治疗等数据。
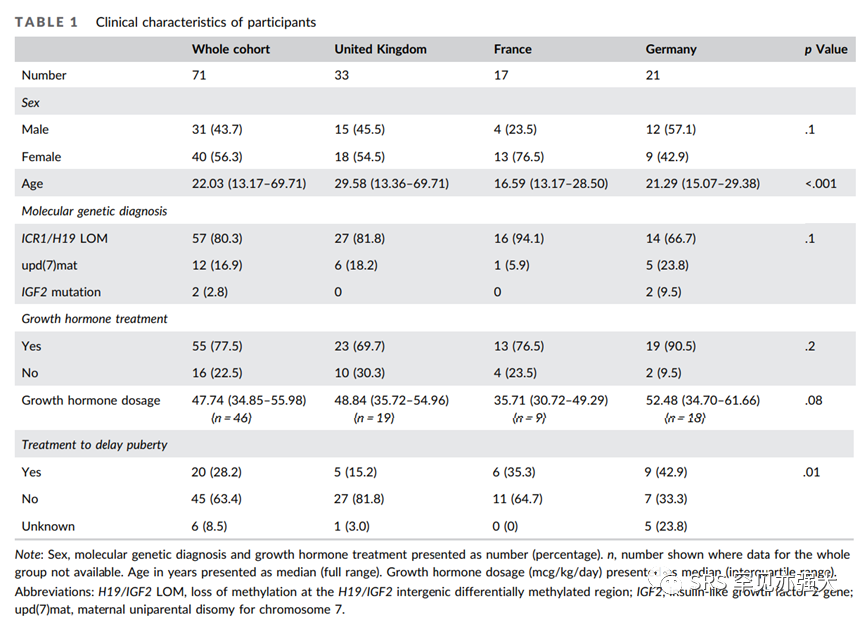
结果:本研究共纳入了71名患者(40名女性),年龄中位数为22.0岁(范围13.2-69.7岁)。经分子诊断:其中80.3%(57/71)的患者为H19/IGF2:IG-DMR LOM,16.9%(12/71)的患者为upd(7)mat,2.8%(2/71)的患者为IGF2基因突变。应用GH治疗的患者占77.5%(55/71)。使用GH治疗的身高增长更大(中位数SDS:1.53vs0.53,p=0.007),而且这些患者在治疗开始时更矮(SDS:-3.46vs-2.91,p=0.04),但最终身高与未接受GH治疗的患者相当(SDS:-2.22vs-2.74,p=0.7)。在GH治疗的患者中,虽然早期BMI SDS与未接受GH治疗的患者相似(中位数:-2.65vs-2.78,p=0.3),但最近一次评估时BMI SDS更低(中位数:-1.10vs1.66,p=.002),BMI增长更低(2.01vs3.58,p=.006)。
讨论:本研究结果支持在SRS中应用GH以提高身高SDS。GH治疗与成年更低的BMI有关,这可能反映出即使在治疗停止生长激素后也可以改善代谢状况。
介绍
Silver-Russell综合征(SRS)是一种以产前产后生长不良为特征的疾病,导致出生时体重不足(SGA),身材矮小,身体不对称,相对巨头,前额突出和儿童期喂养困难,诊断标准采用Netchine-Harbison临床评分系统(NHCSS)。
在SRS病例中,11p15.5区间H19/IGF2(H19/IGF2 DMR)区域甲基化缺失占50%-60%。7号染色体母源性单亲二倍体(upd(7)mat)占5%-10%。CDKN1C、IGF2和PLAG1/HMGA2通路的突变是SRS的散发原因。如果存在临床诊断(即至少满足NHCSS的4/6项指标)但未得到分子证实,并排除了其他可能的诊断,则使用“临床SRS”这个术语。SRS与其他印记障碍,如Temple综合征和染色体20母源性单亲二倍体有很大的重叠。因此,分子遗传学测试可用于确认临床诊断。
出生体重不足(SGA)且身材矮小的SRS儿童可以接受生长激素(GH)治疗以增加成年身高,但其在使用方面存在国际差异。最新的国际共识提倡对SRS进行早期GH治疗,以减少低血糖的风险,提高身高并优化体型结构。SRS的GH治疗可以加快身高增长速度,提高身高标准差分数(SDS)。身高的增长与治疗开始时的身高和年龄呈负相关。青春期时的身高和治疗的持续时间与身高增长呈正相关。更高的目标身高SDS会对身高增加产生正面影响。GH治疗与增加最终身高SDS有关,而最终身高SDS也与治疗开始时的身高呈正相关。两项研究发现,在接受GH治疗的人群中,男性的最终身高SDS要比女性高。但这些研究都包括分子诊断的SRS和临床SRS患者,其中许多并未包括有关青春期骨龄推进治疗的详细信息,如果未经治疗,可能会影响SRS的最终身高。
在临床和分子诊断的SRS病例中报道了因喂养困难导致患者外观极度消瘦。三项有关SRS儿童的研究中报告了BMI的评估:一项有关分子和临床诊断的SRS的研究报告了平均BMI SDS:-2.2(SD:1.2)。另一项有关分子确认的SRS的研究,69%接受了GH治疗,报道了总体的平均基线BMI SDS:-2.4(SD:0.8)。还有一项研究了分子和临床诊断的SRS食欲刺激的效应,其中8.8%接受了GH治疗,中位数基线BMI SDS:-2.8。一些患者包括在多个研究队列中,他们在一个时间点或在短期干预前后报告了BMI,并没有评估GH对BMI的影响,但他们说明SRS的BMI在儿童期通常较低,成人的信息较少。最近一项有关分子诊断的7名SRS成人的病例中,BMI SDS范围从-2.8到2.5(相应的BMI为16.3-32.3kg/m2),表明一些患者的BMI在成年后明显增加。其中7人中有2人(28.6%)接受了GH治疗,但没有比较GH治疗组之间的BMI。一项29名分子和临床诊断的SRS接受GH治疗的研究发现,在GH治疗开始时,BMI平均SDS:-2.76(SD:1.1),治疗结束时为-0.30(1.1)(治疗结束时的平均年龄为15.7(SD:1.5)岁)。脂肪质量百分比SDS在GH治疗开始时为-0.51(SE:0.3),在治疗期间和治疗中止后6个月内均有所增加,但随后稳定。未报告BMI SDS。
越来越多的人关注SRS患者在身高、代谢健康、“生活体验”和成人表型方面的长期结果。我们报告了第一项研究,比较排除了其他因素的分子诊断的SRS个案组,接受GH治疗和无治疗在身高和BMI方面的长期结果。
材料和方法
纳入标准:分子确认的SRS(H19/IGF2 LOM,upd(7)mat和IGF2突变),年龄≥13岁。英国、法国和德国经分子诊断的SRS队列,表1为临床参与者的特征。
研究方法:回顾性观察性研究。
结果
GH对总体队列身高的影响(表2)
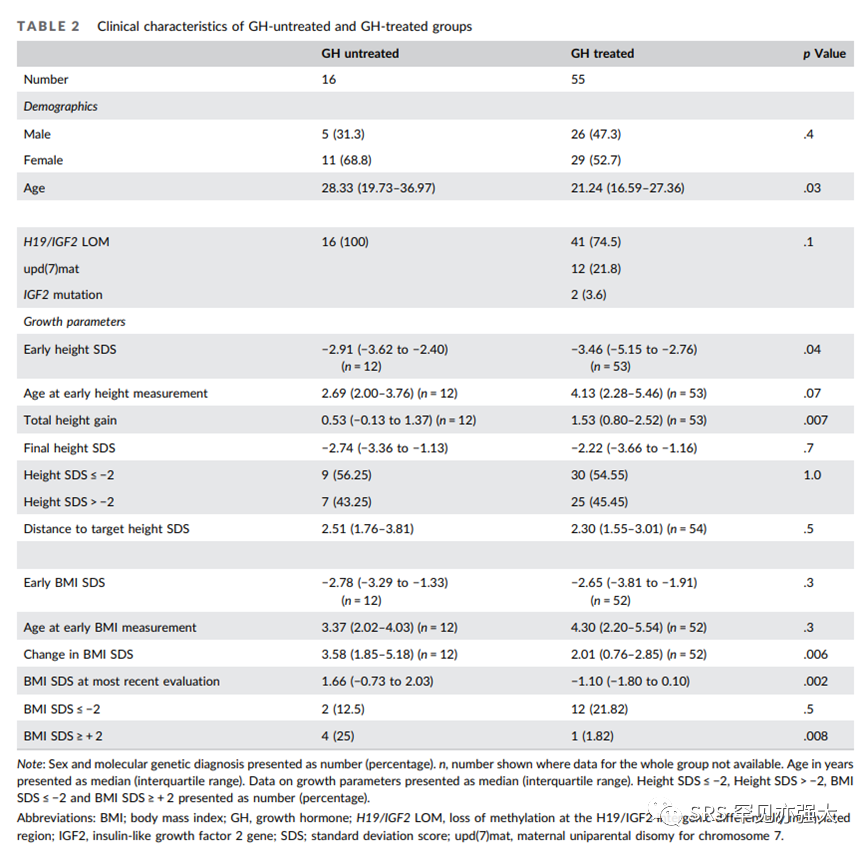
GH治疗的接受率为77.5%,持续时间的中位数为7.1年(四分位距[IQR]:4.0-11.0)。平均GH剂量的中位数值为47.7mcg/kg/d(IQR:34.9-56.0)或1.57mg/m2/d(IQR:1.13-1.89)。GH剂量在不同国家之间略有差异(p=0.08)。开始接受GH治疗的中位年龄为5.8岁(IQR:4.5-9.0),自GH停药以来的中位时间为10年(IQR:2.7-16.0)。GH未接受组的年龄比GH接受组大;中位年龄分别为28.3岁和21.2岁(p=0.03)。GH接受组的总身高增长显著大于GH未接受组(增长中位数SDS:1.53vs0.53,p=0.007)。GH接受组早期身高SDS低于GH未接受组(SDS:-3.46vs-2.91,p=0.04)。两组的最终身高相似(SDS:-2.22vs-2.74,p=0.7)。
在GH接受组中,开始治疗前4岁以下的患者(n=13)在治疗开始时更矮(中位数SDS:-5.26vs-2.98,p=0.001),在治疗过程中身高SDS增长更多(3.13vs1.42,p=0.03),且SDS在早期身高和最终身高之间的增长也更多(SDS:2.57vs1.25,p=0.02)。
与后期开始治疗的患者(n=42)相比,童年时较高的患者在最终身高上更高,目标身高更高的患者最终身高也更高。女性与较低的最终身高相关。分子诊断与身高结果之间存在相关性,upd(7)mat和IGF2突变病例显示出更大的最终身高SDS(β=0.43,CI:-0.04到0.90,p=0.07)。
对H19/IGF2 LOM患者进行了子分析,结果显示:GH未接受组和GH接受组的最终身高SDS相似(中位数分别为-2.74和-2.24,p=0.9),GH接受组的总身高增长更大(SDS:1.47vs0.53,p=0.02)。
促性腺激素类似物治疗对身高的影响
19名患者接受了GnRHa治疗,开始治疗的中位年龄为10.8岁(IQR:9.6-11.3,n=19),治疗时间的中位数为2.3年(IQR:1.8-3.1,n=18)。在来自不同国家的队列中,接受延迟青春期治疗的参与者比例存在差异(p=0.01),但其他特征是可比较的,男女比例没有明显差异(39.3%vs24.3%,p=0.2)。在20例接受延迟青春期治疗的病例中,95%接受了GnRHa治疗,10%接受了醋酸环丙孕酮治疗,有一人接受了两种治疗。然而,此群体中延迟青春期治疗与身高增长总量或最终身高SDS没有显著差异,但样本数量较小(未显示数据),且在所有使用GnRHa治疗的病例中,同时也使用GH治疗。
GH对BMI的影响(表2)
在整个队列中,GH接受组和GH未接受组早期的BMI SDS相似(中位数SDS:-2.65vs-2.78,p=0.3)。与GH接受组相比,GH未接受组的BMI SDS变化更大(中位数SDS:3.58vs2.01,p=0.006),而在最新评估中GH未接受组的BMI SDS更高(中位数SDS:1.66vs-1.10,p=0.002)。在GH未接受组中,有25%(4/16)的人在最新评估中BMI SDS≥2,而GH接受组中只有1.8%(1/55)的人(p=0.008)。在GH未接受组中,有12.5%(2/16)的人在最新BMI SDS≤-2,而GH接受组中有21.8%(12/55)的人,但差异不显著(p=0.5)。
GH治疗与最近评估时的BMI SDS较低有关(SDS:β=-1.89,CI:-3.15到-0.64,p<0.004)。那些最初BMI SDS更高的人,在随访中BMI SDS更高(SDS:β=0.57,CI:0.29–0.85,p<0.001)。性别、分子诊断和GnRHa/醋酸环丙孕酮治疗与最近评估的BMI SDS或BMI SDS变化均无关。
对仅有H19/IGF2 LOM基因异常的患者进行了子分析,发现未接受GH治疗组BMI SDS的变化大于接受GH治疗组(中位数SDS:3.58vs1.95,p=0.008),未接受GH治疗组在最近的评估中BMI SDS更高(中位数SDS:1.66vs-1.09,p=0.003)。法国队列中有一名患者接受了芳香化酶抑制剂治疗,但未获得治疗的详细信息。
讨论
本研究是第一次比较GH治疗和未治疗的分子诊断的SRS在生长方面的结果。只包括分子诊断的SRS病例非常重要,因为SRS的临床特征与其他疾病重叠,并且历史队列中包括了胎儿宫内生长迟缓出生的婴儿和SRS患者。因此,先前的研究结果并不一定真实反映分子诊断的SRS病例的生长状况。我们研究了一组年龄较大、分子诊断的SRS患者,并评估了先前接受GH治疗和未接受GH治疗的患者的身高和BMI差异。随着GH的普及使用,越来越难找到这样的对照组。本研究旨在评估之前的治疗,提供支持医疗专业人员和家庭决策的证据。
本研究新发现,对于分子诊断的SRS患者,GH治疗与在后期获得更高的身高增长和较低的BMI指数有关。GH治疗可使SRS患者获得更高的成年身高,包括分子和临床诊断的SRS患者。GH治疗与更大的身高增长有关,这为支持GH治疗以促进SRS的身高提供了进一步的证据。
在早期,GH治疗组身高更矮,受到SRS的影响可能更严重。身材较矮的人也更有可能接受治疗。在本研究中,GH治疗组的最终身高(中位数SDS:-2.22)与之前GH治疗患者的研究相当。然而,之前的队列包括分子和临床诊断的SRS患者,而本研究仅包括分子诊断的SRS。
研究结果表明,GH治疗的开始年龄与身高增长呈负相关,与先前的研究发现类似,提示应考虑在SRS早期开始治疗。在本研究中,女性比男性最终身高SDS更低,与之前的结果一致。造成这种现象的原因还不清楚,但可能是因为SRS患者的生长板对性激素的敏感性存在差异。在小鼠生长板上显示出雌二醇所特有的性依赖性效应支持了这个理论。治疗延迟青春期的男女比例没有差异。然而,本研究未评估青春期发育的身高和年龄,这是进一步研究的领域。
本研究已经证明了先前的GH治疗和治疗后较低的BMI之间的关联。GH治疗在SGA中证明可以促进肌肉的发展和减少脂肪的含量,同时增加中心脂肪的分布。但有一组数据显示在SRS和非SRS SGA患者中,接受GH治疗时脂肪质量SDS在治疗期间和2年后增加,这与另一项研究显示在出生时低体重的成年人接受或未接受GH治疗时脂肪含量和脂肪分布相似。据我们所知,只有一项研究仅评估了SRS的体成分,但该研究仅限于7例病例,患者年龄比本研究还年轻(平均年龄为26.9±9.1岁,范围为18-46岁),其中2/7例接受了GH治疗,并未分析治疗效果。据我们所知,尚未对SRS患者GH治疗后的长期BMI进行评估。我们推测,低BMI的结果来源于体成分的差异,包括GH治疗患者体脂肪含量的降低。GH治疗患者在儿童期可能更加活跃,因此可能会养成有益的运动习惯并延续到后期。GH治疗的人中的低BMI结果是一个新发现,我们推测该治疗可能会影响更长期的代谢结果。
本研究有一些限制。首先,本研究是一项回顾性观察性研究,尽管身高和体重测量是由临床医生测量的,但有些数据(例如出生参数)是从患者、父母和医疗记录中收集的,有些数据无法获得。虽然治疗组男女比例相似,但无法获得SRS患者的种族和社会经济状况的信息。治疗组之间可能存在其他差异。参与者可能存在回忆偏差,且并非所有病例都有医疗记录可供验证信息。其次,参与者在不同的历史时间点接受了治疗,在此期间,医疗实践已经发生了变化。没有办法确定GH治疗的适应症或使用的方案。GH未治疗组更年长,在GH治疗组中,年龄范围广泛,因此,本研究所报道的治疗可能并不代表当前的实践。GH的平均剂量也高于目前的治疗建议。GH未治疗组的年龄较大可能会影响该组的BMI。未接受治疗的SRS个体越来越少,因此对该群体的评估仍然具有价值。第三,不同国家的临床实践可能会有所不同。最后,其他可能未被测量到的混杂因素无法进行检验。例如,给予GH治疗的医疗团队和没有给予GH治疗的医疗团队之间可能存在差异。避免出生体重过轻的患者体重增加可能会有更好的建议。目前还没有关于安全性方面的数据。
本研究结果表明,分子诊断(H19/IGF2 LOM vs upd(7)mat vs IGF2突变)影响最终身高,但本研究尚不足以评估这一点。虽然GH治疗或其疗程的比例并没有差异,但不同国家之间在附加GnRHa治疗方面存在差异,临床推理的细节不可得知,因此无法应用一致的方法来评估该治疗。此研究未显示GnRHa治疗本身对最终身高SDS或总身高增长的贡献,因此我们并没有证据表明不同国家之间GnRHa治疗的差异会影响结果。然而,在SGA的儿童中,以2年GnRHa与GH的联合治疗已显示出在成年后有更好的身高,并且身高增长更多。在临床和分子诊断SRS女孩中,从青春期到成年身高的增长也已经表明通过GnRHa的治疗可以有更好的生长结果。总之,我们的数据显示,在分子诊断的SRS患者中,GH治疗会促进身高增长,并在以后的生活中降低BMI(尽管GH治疗早已停止)。GH治疗带来长期较低的BMI可能表明代谢健康的预后更好。
参考文献:Lokulo-Sodipe, O., et al., Height and body mass index in molecularly confirmed Silver-Russell syndrome and the long-term effects of growth hormone treatment. Clin Endocrinol (Oxf), 2022. 97(3): p. 284-292.