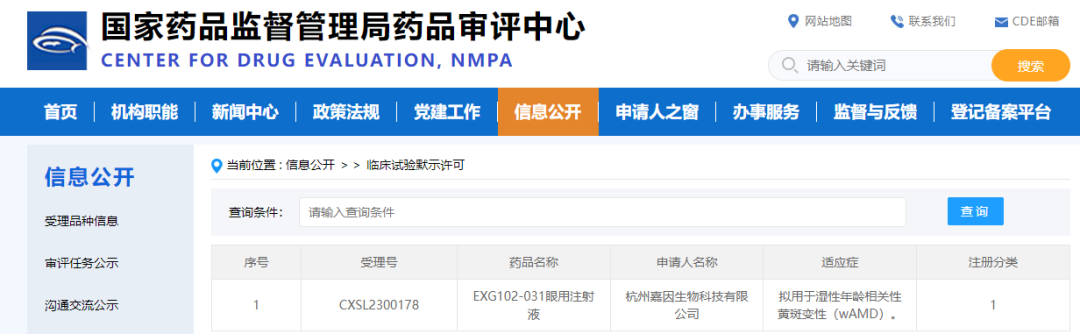
2023年6月1日,杭州嘉因生物EXG102-031眼用注射液再获中国国家药品监督管理局药品评审中心(CDE)临床试验默示许可,同意开展治疗湿性年龄相关性黄斑变性( wAMD) 的临床试验,(受理号:CXSL2300178)。
该管线是目前首个针对所有已知VEGF和ANG2亚型的nAMD临床阶段的基因疗法。 这是杭州嘉因生物获得中国国家药品监督管理局药品评审中心(CDE)批准的第二款产品,首款产品为2022年6月21日获得NMPA批准开展临床试验的 EXG001-307,这是首个进入临床的国产1型脊髓性肌萎缩(1型SMA)基因疗法。在今年2月,该药物已完成首例受试者入组给药,并在用药后7天安全性随访后顺利出院。截至目前,受试者们安全性及耐药性均表现良好。 公司成立4年来,好消息接踵而至,新成果势如破竹,这是对杭州嘉因生物具有世界前沿水平的研发、CMC、质量和注册能力的强有力证明,我们兢兢业业,努力奋斗,只为进一步加速开发创新型的基因治疗产品,应用于高度未被满足的临床需求领域,给全球患者带来福音 |关于EXG102-031 EXG102-031 眼内注射是一种基于rAAV的基因疗法,表达一种治疗性融合蛋白,能够结合/中和所有已知的血管内皮生长因子(VEGF)和血管生成素-2(ANG2)亚型,与现有的需要反复注射的抗体药物不同,只需要一针注射,就可在体内长期表达并有望有效治疗视网膜中异常血管形成和血液渗漏。 EXG102-031的 I 期临床试验将评估EXG102-031在wAMD患者中的安全性和耐受性,同时也会评估其对患者的视力改善程度。