4月11日,REGENXBIO宣布,美国FDA授予该公司潜在的一次性基因疗法RGX-202快速通道资格(FTD),用于杜氏肌营养不良症的治疗。

杜氏肌营养不良症(Duchenne muscular dystrophy,简称Duchenne)是一种罕见的遗传性疾病,因负责生成肌营养不良蛋白(dystrophin,一种对肌肉细胞结构和功能至关重要的蛋白质)的基因发生突变引起。Duchenne主要影响男性,在全球范围内,大约每3500-5000名新生男性中就有1人发病。
Duchenne患者功能性肌萎缩蛋白的缺失会引起肌肉收缩时细胞损伤,导致细胞死亡、炎症和肌肉组织纤维化。Duchenne一般在5岁前发病,初始症状包括肌肉无力,通常在早期明显。随着时间的推移,患者逐渐出现肌肉无力,最终失去行走能力。此外,患者的呼吸和心脏肌肉也会受到影响,导致呼吸困难,需要呼吸机辅助,同时出现心肌病。Duchenne目前尚无治愈方法。
RGX-202旨在提供一种新型微小肌萎缩蛋白的转基因,其中包括在自然产生的肌萎缩蛋白中发现的c-末端(CT)结构域的功能元件。在临床前研究中,CT结构域的存在已被证明可以将几个关键蛋白质招募到肌肉细胞膜,从而改善营养不良小鼠的肌肉抵抗肌肉收缩引起的损伤。
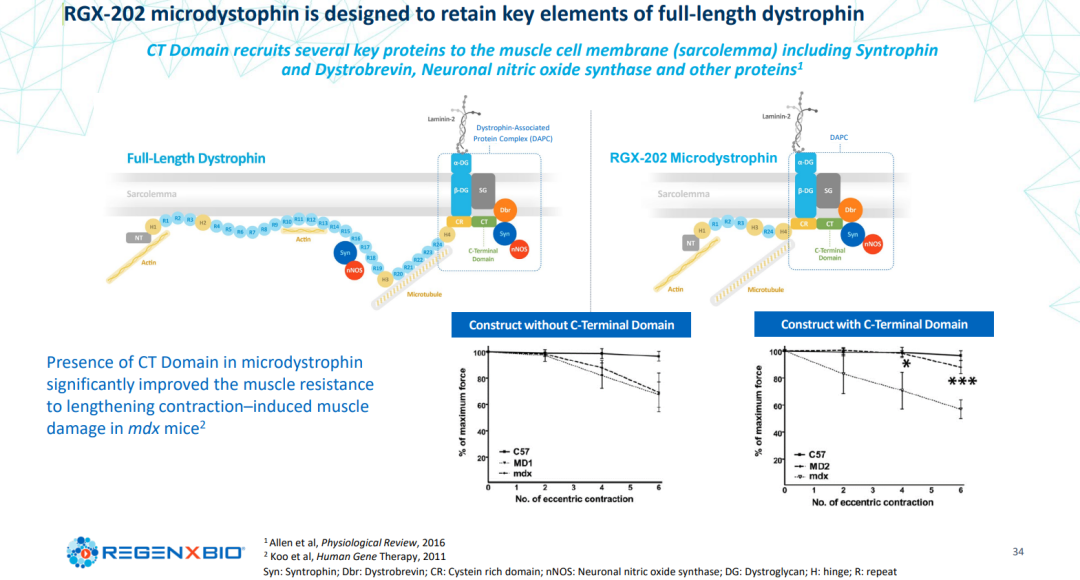
RGX-202的其他设计特征包括密码子优化和降低CpG含量,可能潜在地改善基因表达,提高翻译效率和降低免疫原性。通过设计,RGX-202可通过NAV AAV8载体和一种特征良好的肌肉特异性启动子(Spc5-12)在骨骼和心肌中进行基因的传递和靶向表达。RGX-202已被FDA授予快速通道、孤儿药和罕见儿科疾病用药称号。
今年1月,REGENXBIO宣布,RGX-202用于治疗Duchenne的I/II期AFFINITY DUCHENNE™试验已启动并招募患者。该试验是一项多中心、开放标签剂量评估和剂量扩展研究,旨在评估一次性静脉注射RGX-202对Duchenne患者的安全性、耐受性和临床疗效。6例门诊儿科患者(年龄4-11岁)将被纳入两个队列,剂量分别为1x1014个基因组拷贝(GC)/kg体重(n=3)和2x1014个GC/kg体重(n=3)。
罗氏28.5亿美元引进的治疗杜氏肌营养不良症基因疗法SRP-9001(delandistrogene moxeparvovec)已于2022年7月29日在美国申报上市。