近日,HaemaLogiX在美国癌症研究协会(AACR)年会上展示了其候选产品Kappa骨髓瘤抗原(KMA) CAR-T疗法的临床前数据,这一数据证明了这一疗法具有治疗多发性骨髓瘤(MM)的潜力。HaemaLogiX将继续推进这一疗法向临床阶段迈进。

选择肿瘤治疗靶向抗原的理想情况是这一抗原仅表达在癌细胞表面而在其他正常细胞中不表达或表达量极低。HaemaLogiX已经发现并鉴定了两种抗原:KMA和Lambda骨髓瘤抗原(LMA)。它们存在于血液瘤(如多发性骨髓瘤、某些淋巴瘤、Waldenstrom巨球蛋白血症)细胞的表面,尽管也会存在于扁桃体和少数单核细胞中,但在任何其他正常免疫细胞或组织中均未发现,具有高度特异性。通过细胞和其他免疫疗法靶向KMA和LMA具有保持正常浆细胞群不变的潜在优势,并将治疗后严重感染的风险降至最低。
多发性骨髓瘤被称为“单克隆”癌症,患者体内的所有骨髓瘤细胞都来自一个原始癌症细胞。据HaemaLogiX官网的数据显示,患者的骨髓瘤细胞上表达KMA或LMA,一般而言有约70%的髓瘤患者细胞表达KMA,约30%的表达LMA。
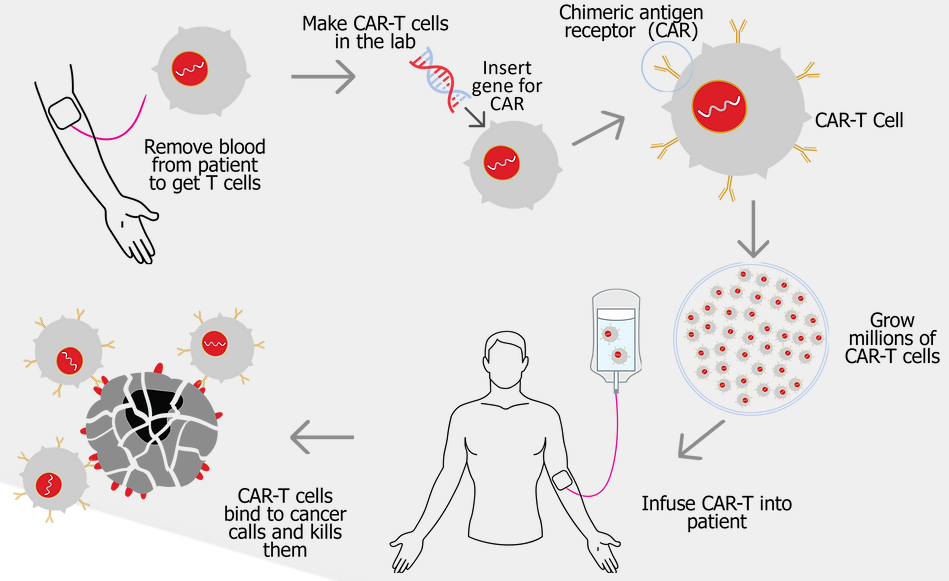
HaemaLogiX研发的KMA CAR-T疗法是利用病毒载体将能够形成KappaMab结合域和T细胞内激活结构域的特定基因引入T细胞从而产生特定的CAR,再培养这些CAR-T使其扩增到十亿数量级。目前KMA CAR-T疗法已经完成临床前开发,正计划推进1期临床研究;另一款LMA CAR-T疗法正在研究和发现阶段。
值得一提的是,HaemaLogiX的开发策略是围绕KMA、LMA进行布局,除了CAR-T疗法外,还有单抗和双抗。其中双抗尚处于临床前研发阶段,单抗已有产品进入临床。KappaMab是一种用于κ型多发性骨髓瘤的单抗,包含两个抗原结合区和一个恒定区。当两个抗原结合区域与体内癌细胞结合时,免疫细胞(如NK细胞)就会与抗体的恒定区域结合从而激活细胞杀死癌细胞。
该疗法的1期临床试验表明,给予KappaMab治疗后,没有剂量限制性毒性,并且在最高剂量下未达到最大耐受剂量。目前2期试验已经完成,预计较高剂量的KappaMab不会导致额外的安全问题,并可能增加反应的深度和持续时间。HaemaLogiX计划启动KappaMab联合泊马度胺加地塞米松治疗标准护理治疗失败的患者的临床试验。
MM潜力靶点
除了KMA、LMA两个靶点外,目前还报道了众多针对MM的靶点。
SLAMF7(CD319、CRACC、CS-1)
SLAMF7是信号转导淋巴细胞活化分子(SLAM)家族的成员,是一种表达于骨髓瘤细胞表面的糖蛋白,同时也表达于NK细胞和免疫细胞亚群。当抗体与SLAMF7结合可以激活NK细胞和固有免疫,激活NK细胞直接杀死肿瘤细胞。
不过研究表明CAR-T细胞制造过程中SLAMF7高表达的T细胞会发生自噬,因此可能会发生SLAMF7高表达淋巴细胞的选择性缺失。目前已有SLAMF7 CAR-T进入临床,治疗效果如何还有待临床数据公布。
GPRC5D
GPRC5D是G蛋白偶联受体家族C组5成员D,属于一种孤儿受体。一般情况下仅在毛囊中表达,而在MM中特异性高表达,是一种有潜力的靶点。对于BCMA阴性或BCMA低表达的MM病患来说,在接受靶向BCMA CAR T-细胞治疗后仍会复发,存在靶向逃逸问题。
而临床前研究表明,GPRC5D具有更好的特异性,在发生了BCMA逃逸的模型中,能很好的清除肿瘤并延长存活期。目前,纪念斯隆凯瑟琳癌症中心的GPRC5D CAR-T细胞疗法正处于1期临床研究阶段。
CD38
CD38是一个胞膜蛋白,约90%的CD38分布在细胞膜上,能够参与调节细胞的迁移、受体介导的粘附、与CD31或透明质酸的相互作用。其在正常的髓系细胞、淋巴细胞以及非造血细胞上低表达,但在浆细胞和MM细胞中高表达。
目前这一靶点的抗体已经进入临床,其中强生研发的Daratumumab/达雷木单抗是目前唯一一款已经在中国上市的CD38单抗。或许这一靶点未来有希望用于CAR-T疗法。
总结
或许KMA/LMA CAR-T疗法将会在后续临床试验中展现出令人振奋的效果。目前,寻找新的更具有治疗潜力的靶点是细胞治疗的趋势。尽管当下针对创新靶点的研发数量较少,且大多处于临床前或临床早期阶段,但我们相信随着研发的深入和技术的发展,创新疗法的安全性和疗效将会进一步提升。
参考资料:
1.企业官网