导读:各位亲爱的朋友,由于本文是由台湾方面的相关单位编写,为了尊重原创,病友家园故此没有把文体转换为简体字,虽然繁体字看起来可能会有些不习惯,但希望大家还是可以理解。顺便温故一下繁体字也是不错的哦!
邱司漢 黃立言 孫毅麟 譚光還 黃毓龍 石光中
國軍桃園總醫院 內科部
三軍總醫院 內科部新陳代謝科 家庭醫學部
桃園榮民醫院 骨科部 麻醉部
台北榮民總醫院 內科部新陳代謝科
肢端肥大症(acromegaly)是一罕見疾病,特徵是器官不正常的增生或肥大,尤其在四肢和顏面。過量生長素(growth hormone, GH)的分泌,在青春期之前,因骨骺尚未閉合,因此會引起巨人症(gigantism);而在青春期之後,則會導致肢端肥大症。生長素分泌過多的病程通常是緩慢的,其會逐漸影響代謝功能和生長發育。診斷標準包括了臨床症狀、生化檢驗和影像發現。生化檢驗主要是生長素的濃度無法被葡萄糖所抑制(生長素的濃度仍然>1 ng/mL)或類胰島素生長因子-1 (insulin-like growth factor 1, IGF-1)超過正常值。治療原則主要是減少生長素和IGF-1 的分泌,如果病人罹患垂體腫瘤,則經蝶竇垂體腺瘤切除術(trans-sphenoid pituitary adenomectomy)應是治療的首選,以減少腫瘤的大小與分泌。如果外科手術無法將生長素和 IGF-1 的濃度減至正常,則可考慮內科療法,治療藥物主要是體抑素類似物(somatostatin analogues)或合併放射治療。使用體抑素類似物出現明顯的抗性或副作用時,則可考慮使用生長素受體拮抗劑(growth hormone receptor antagonist)。近年來,肢端肥大症的病人在免疫系統、心血管系統、呼吸系統和代謝方面的預後,已有明顯改善。
關鍵詞:巨人症(Gigantism)
肢端肥大症(Acromegaly)
生長素(Growthhormone)
類胰島素生長因子-1(Insulin-like growth factor 1, IGF-1)
垂體(Pituitary)
前言
肢端肥大症主要是垂體分泌生長素的細胞出現增生或產生腺瘤所致,因此會分泌過
多的生長素。正常成人血漿生 長素的 濃度< 2 ng/mL,而 肢端 肥大 症的 病人,其濃度可高達100-1,000 ng/mL,治療後仍可下降至正常。過量生長素的分泌,在青春期之前,因骨骺尚未閉合,因此會引起巨人症;而在青春 期之後,則會導致肢端肥大症。此疾雖不常見,但病人多會伴有軟組織、骨骼及內臟的增生肥大,垂體前葉 功能亢進,晚期體能衰退,垂體前葉因腫瘤增大壓迫,而引起繼發性垂體前葉功能低下。此病佔垂體腫瘤中的第二位,如果沒有適當治療,會增加病人的死亡率,男女比約為 1:1,發病年齡以 40-45 歲最多 。
聯絡人:石光中 通訊處:11217 台北市北投區石牌路二段201號 台北榮民總醫院內科部新陳代謝科 邱司漢 黃立言 孫毅麟 譚光還 黃毓龍 石光中
流行病學
肢端肥大症俗稱為「大肢 症」,是一種罕見的疾病,根據國 外的調查,盛行率每百萬人口約 40-70 位,而每 年每百萬人口,可以出現 3-4 位的 新病例 。也就是說,台灣大約有800多位肢端肥大症的病人,每年約可見60位的新病例。但最近二個國外研究顯示,其實肢端肥大症的盛行率應該更高,比利時統計為每百萬人口約100-130位 ,德國則為每百萬人口約有1,000位 。
病因
一、 生長素分泌過多:造成生長素分泌過多的原因, 包括了垂體腫瘤(pituitary tumor) 和外垂體腫瘤 (extra-pituitary tumor) 二大類,佔 99%。
(一)
垂體腫瘤:其發生的機轉不明,可能在G蛋白的a亞單位(a-subunit) 發生點 突變,而使腺苷酸環化酶 (adenylate
cyclase)自動啟動,通過cAMP使蛋白質磷酸化,使細胞生長及分化,形成分泌生長素的腫瘤 。生長素分泌過多的原因有 98%
是垂體發生問題,肢端 肥大症病人的垂體大多屬於生長素分泌細胞腺瘤,少數為增 生或腺癌。依其分泌細胞的型態可分為
(1)
緻密顆粒型或稀疏 顆粒 型生長 素細 胞腺瘤 (densely or sparsely granulated GH cell
adenoma):屬於完全體促素細胞垂體腺瘤 (pure somatotroph pituitary adenoma), 約佔60%。
(2) 混合性生長素和泌乳素細胞腺瘤 (mixed GH cell and prolactin cell adenoma): 同時分泌生長素和泌乳素,約佔25%。
(3) 體乳促素細胞腺瘤 (mammosomatrope cell adenoma):約佔10%。
(4) 其他較少見的腫瘤:僅佔3%,例如:
(a)
多激素分泌細胞腺瘤(plurihormonal adenoma): 可分泌濾泡促素(follicular
stimulating hormone; FSH)、黃體促 素(luteinizing hormone; LH)、甲狀腺促素
(thyroid stimulating hormone; TSH)和絨毛膜促性腺素 (chorionic gonadotropin
hormone; CG) 等。
(b) 生長素細胞癌或轉移(GH cell carcinoma or metastases):大多數的腺瘤 為良性,少數為腺癌 ( 病例數發表不到20例 ) 。
(c) 第 1 型多發性內分泌腫瘤(multiple endocrine neoplasia-1):偶可見。
(d)
異位蝶竇或旁咽喉竇性垂體腺瘤 (ectopic sphenoid or parapharyngeal sinus pit ui tary
adenoma)。垂體腫瘤直徑 >10 mm
時,大約有三分之一的腫瘤已伸向蝶鞍外,約三分之一的腫瘤具有侵襲性,影響骨頭和硬腦膜。由於生長素分泌過多,繼而使 IGF-1 產生過多。
(二) 外垂體腫瘤:僅佔 1%,例如:胰島細胞腫瘤和淋巴癌等。
二、 生 長 素 釋 素 (growth hormone-releasing hormone) 分泌過多:造成生長素釋素分泌過多的原因,包括了中樞 (central) 和周邊(peripheral) 二大類,二者佔不到 1%。
(一) 中樞: 下視丘生長素釋 素分泌瘤,例如:錯構瘤 (hamartoma)、迷行瘤 (choristoma)、神經節細胞瘤 (ganglioneuroma) 等。
(二) 周邊: 異位性生長素釋 素分泌瘤,例如:支氣管類癌瘤、胰島細胞腫瘤、肺小細胞癌、腎上腺腺瘤、甲狀腺髓樣癌和嗜鉻細胞瘤。但臨床肢端肥大症的症狀 並不明顯,主因是其所合成的生長素釋素量,尚不足以刺激垂體分泌過多 的生長素有關。但這些腫瘤的惡性度較高,易縮短病人的壽命。
臨床症狀
肢端肥大症發病一般較為緩慢,臨床表現決定於垂體腫瘤的大小、發展速度、生長素分泌的情況,和對正常垂體組織壓迫等影響。肢端肥大症既有生長素分泌過多,又可能有促性腺素、甲狀腺促素、腎上腺促皮質素分泌不足等,使功能亢進和功能減退相混雜。垂體腫瘤可引起頭痛、視力模糊、視野缺損、眼外肌麻痺、複視;大多數因為生長素分泌過多而表現出全身軟組織、臟器及骨骼增生肥大;引起骨、
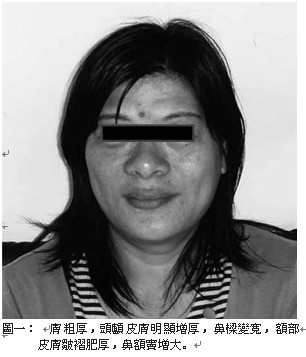
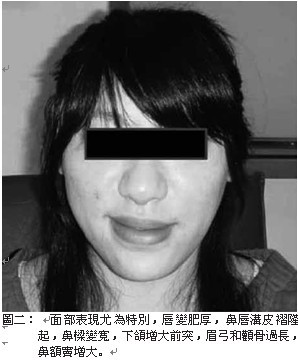
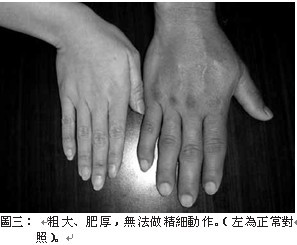
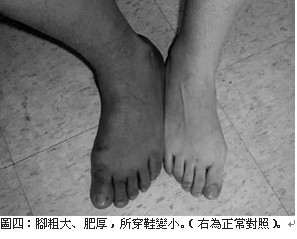
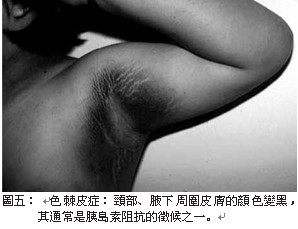
軟骨、關節和軟組織過度生長而出現一系列的症狀,例如:皮膚粗厚(圖一)、皮脂腺分泌亢進(油質感),汗腺分泌亢進而多汗,顏面部(圖二)表現尤為特別,唇變肥厚,鼻唇溝皮褶隆起,頭顱皮膚明顯增厚褶疊呈腦迴狀,額部皮膚皺褶肥厚,鼻樑變寬,舌頭粗且大。頭圍變大,下頜增大前突,齒距增寬,咬合困難,發生顳頜關節炎,眉弓和顴骨過長,鼻額竇增大,聲帶變粗厚,導致發音低沉。手(圖三)腳(圖四)粗大、肥厚,無法做精細動作,所穿鞋帽手套變小,成年後仍需增大尺寸。而且由於手腕韌帶變厚,腕部軟 組織增生可壓迫 正中神經,兩手會發麻。足跟墊可增厚,肌肉軟弱無力,甚至表 現肌肉疼痛。可見皮膚色 素沉著症、黑色棘皮症 ( 圖五 ) 和多毛等 。
在骨質密度方面,皮質骨會變厚,其多孔性消失。海綿骨則是部分密度增加或減少都有可能。最近一篇研究顯示,雖然肢端肥大症病人的骨質密度和正常人沒有差別,但在脊柱骨折的發生率較高(57.5%vs. 22.6%)。骨關節病和關節疼痛發生率也較高,約 30-70%,包括肩、髖、膝關節、腰骶椎,關節活動障礙,關節僵硬,脊柱後突並有桶狀胸,換氣功能障礙,促使肺部疾病的發生。肺部疾病發生率增高、肺功能異常、肺活量降低、肺容量增加,產生上呼吸道和氣道狹窄,從而增加呼吸道感染、喘鳴和呼吸困難;會有睡眠呼吸終止症候群(sleepapnea syndrome),發生率約 60-80%,尤其是男性。其中大部分是阻塞性,另有三分之一是中樞性,與舌大產生脫垂、咽下部塌陷有關,故會增加病人的死亡率。
心血管疾病主要表現在心肌肥厚、間質纖維化、心臟擴大、左心室功能減退、高血壓、冠心病和動脈粥樣硬化等,剛開始時,可能沒有任何症狀。另外產生高血壓與鈉滯留、細胞外容積增加、腎素-血管張力素-醛固酮系統(renin-angiotensin-aldosterone system, RAAS)活性降低、增加交感神經系統興奮有關,高血壓進一步會造成心肌肥厚。心臟超音波顯示心臟輸出功能改變(不正常心室填充),造成舒張功能異常 ,此時心臟收縮功能仍正常。另外,在疾病的早期就可能會出現心律不整,約有 40%的肢端肥大症病人併有心室期外收縮(ventricularpremature complexes),大部分心律不整是無症狀,且在治療肢端肥大症成功後,依然持續存在。心血管病變與生長素升高和病程的進展有關,肢端肥大症的病人在 45 歲以後,因為心血管和腦血管粥狀硬化,以及呼吸系統疾病死亡的比率是正常人的2倍。病人可能併有泌乳素分泌過多,而表現出月經紊亂、溢乳、不孕,男性則有性慾降低和陽痿。內臟也會增大,尤其是心臟、腎臟最為明顯,甲狀腺也可能增大。生長素分泌過多會降低胰島素的敏感度或產生胰島素阻抗,葡萄糖耐受不良(16%-46%)乃至糖尿病(20%-56%)。可伴有高三酸甘油酯血症,脂蛋白脂酶(lipoprotein lipase, LPL)活性降低,導致血漿游離脂肪酸增高,生酮作用加強。肢端肥大症的病人會減少內臟脂肪和皮下脂肪的重量,但會增加肌肉脂肪的重量(造成胰島素阻抗)和瘦肉組織(leanbody mass) 。肢端肥大症病人血漿 1,25-(OH)2-D3 的濃度可能增高,因此會增加腸道對鈣的吸收和出現高尿鈣,尿路結石也會增加。若有高鈣血症,應考慮伴有副甲狀腺高能症(多發性內分泌腫瘤)。此外,骨代謝增加,也會造成骨質疏鬆。結腸息肉和結腸、直腸癌的發生率也會增高 ,其與皮膚下垂物(skintags)和息肉的增多有關,但也有文獻認為並不會增加癌症的發生率。如果病人沒有任何症狀,一般超過50歲建議做大腸鏡。早期垂體功能顯著增加,晚期部分激素分泌功能衰退,尤其是促性腺素等衰退較為明顯,更增加了此病的複雜性。實驗室及其他檢查過去測定生長素是用放射性免疫測定法(radioimmunoassays, RIAs),但敏感度不佳。而最近所使用的 two-site immunoradiometricassay(IRMAs),可增加敏感度 。正常人生長素的濃度<5ng/mL(0.235 nmol/L),但也有可能測到分泌脈衝,而呈現較高的濃度。肢端肥大症病人生長素的濃度可達 15 ng/mL,活動期更可高至100ng/mL,有90%以上的病人,其生長素的濃度會>10ng/mL。生長素分泌脈衝的次數增加 2-3 倍,基礎生長素的濃度增加達16-20倍 和24 小時生長素的總值較正常人高出l0-15倍。IGF-1 升高,反映出24小時生長素分泌的總量增加,隨著生長素取 log 值的上升而增加,IGF-1正常的濃度會隨著年齡而遞減,可作為篩檢和疾病活動性的指標,也可作為肢端肥大症治療是否有效的指標。但在懷孕、青春期時,則會有較高的 IGF-1 的濃度,所以在糖尿病、慢性腎衰竭、懷孕、青春期時,使用生長素或IGF-1來診斷或評估治療效果並不適合。IGF-1 主要和類胰島素生長因子結合蛋白 -3 (IGF binding protein-3, IGFBP-3) 結合,在肢端肥大症的病人,其IGFBP-3也會增加,但在臨床診斷方面較少使用。
診斷
典型的肢端肥大症,僅憑症狀及外貌,再加上一系列的生活相片,有經驗的醫師已能診斷。但早期症狀不明顯者,診斷不易。由於生長素的作用緩慢,因此病人外表臉型或體型的變化,很容易被誤認為是年紀增長的關係,導致診斷的時間常會延遲多年。現在由於檢驗技術的進步,生長素濃度的測定,較前更為簡單和方便,再加上精密的核磁共振造影檢查,可以提早 2-3 年發現這種疾病 。生長素的濃度若<0.4 ng/mL 和 IGF-1 的濃度正常,則可排除肢端肥大症,若生長素的濃度>0.4ng/mL 及(或)IGF-1 的濃度偏高,則可加做生長素抑制試驗以確定診斷。如果生長素抑制試驗的結果:生長素的濃度<1 ng/mL,則可排除肢端肥大症;若生長素的濃度仍>1 ng/mL,則肢端肥大症的診斷確立。診斷依據有三點:
一、典型面貌,肢端肥大等全身徵象。
二、內分泌檢查:測定血漿生長素、IGF-1
的濃度和生長素抑制試驗。生長素抑制試驗:口服葡萄糖抑制生長素分泌試驗是診斷肢端肥大症最簡單和最專一性的動力學檢查。試驗開始前膀胱應完全排空,成人給予75g
的口服無水葡萄糖(孩童以1.75 g/kg 計,最大量至75 g),葡萄糖應充分溶解在 300 mL 的溫水中,並於5
分鐘內喝完。服用前和服用後分別於第 30、60、90、120 和 180 分鐘時,抽取
3mL的靜脈血液檢體,注入乾淨的玻璃瓶,以檢測血漿生長素的濃度,並應小心防止病人在任何階段出現嘔吐的現象。正常人服用後 2
小時,生長素的濃度會降至 1ng/mL
以下。而肢端肥大症的病人,其生長素的分泌不受葡萄糖的抑制,其生長素的濃度大都仍>5 ng/mL。但有少數病人在口服葡萄糖後,其生長素的濃度仍會<1 ng/mL,所以最近有些研究建議改用化學發光法(chemiluminescence)和螢光標定(fluoro-metric)來檢測生長素的濃度,生長素的濃度應定在<0.3ng/mL 。
三、放射線檢查:頭顱
X
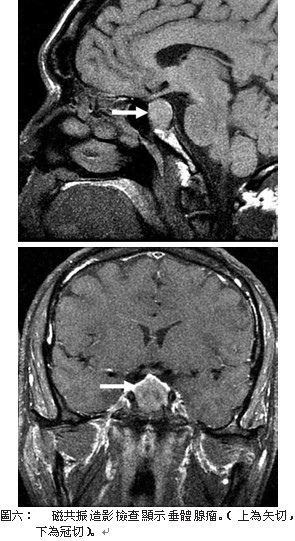
光檢查可見顱骨板增厚、頭顱變大,多數病人可見蝶鞍擴大、前後突破壞、鼻額竇增大。蝶鞍區壓迫症除典型症狀體徵外,蝶鞍增大,床突被侵蝕。指端骨呈叢毛狀,長骨及脊椎骨X片上出現骨質疏鬆,皆為診斷肢端肥大症的重要依據。核磁共振造影檢查較其它的放射線檢查更有助於診斷(圖六),其不僅適用於顱內病變,也可適用於其他處的異位性腫瘤病變
( 例如:胸、腹部 )。
治療
肢端肥大症治療的目標主要有 (1) 降低生長素的濃 度到 <1 ng/mL,(2)IGF-1 的濃 度恢復正常,(3) 症狀減輕 和減少併發症。此外,治療目標還有減少腫瘤的大小和恢復垂體的功能。治療的方法有(1) 藥物治療 (2) 手術治療和 (3)放射治療。診斷和治療的流程,如圖七 。
出現肢端肥大症的臨床症狀:
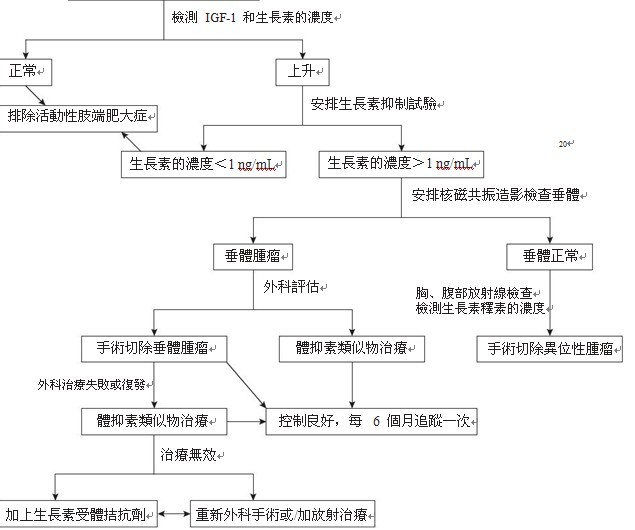
圖七:肢端肥大症的診斷和治療流程。
一、藥物治療
(一) Bromocriptine:能抑制肢端肥大症的病人分泌生長素及泌乳素,抑制生長素時需較高的劑量,為了避免副作用,可從小 劑量(1.25 mg) 開始,於睡前或進餐時與食物一起服用,初始劑量為每日一次,數日後能適應者,可每隔 3-7 日增加 1.25-2.5 mg,逐漸達到有效劑量,有時每日需60-70 mg,一般要15 mg以上,分2-3次服用。約2周後,症狀開始減輕,壓迫症狀減少;2-3 月後呈現明顯療效,甚至腫瘤縮小,生長素和泌乳素明顯下降者約佔 2/3 左右,但 IGF-1 的濃度能夠恢復正常的,只有10%。新一代 cabergoline 的效果較好,此藥是多巴胺促效劑 (dopamine agonists),能夠抑制生長素的分泌,但必須持續治療數年 ( 有報告使用7年以上 ),停藥後易復發,如無效或復發者,常須輔以手術或 放射治療。因此,它只被當作一種輔助治療的藥物,可用於小腺瘤或大腺瘤且已有鞍外壓迫症狀者。約60%的病人會產生副作用,主要是腸胃 道的症 狀 ( 例如: 噁心、嘔吐、消化不良、腹痛 ),其它還有姿勢性低血壓、頭暈、頭痛等。
(二) 體抑素類似物:能抑制體抑素和其受體結合,減少生長素的分泌,體抑素 受體(somatostatin receptor, SST) 有5種亞型,主要是SST2和SST5。此藥作為第一線治療時,可使60-70%病人生長素的濃度 <2 ng/mL,50-80% IGF-1 的濃度恢復正常 ,20-70% 腫瘤變小。如果病人有手術禁忌、其它嚴重疾病,則可考慮在術前使用。它的缺點是需要長期皮下注射,藥價昂貴,停藥後腫瘤仍會復發。副作用是注射部位疼痛和 胃腸道症狀 ( 例如:噁心、腹脹、腹痛、腹瀉等 ),但通常是暫時的,偶見膽結石。最近有研究顯示,該藥會使胰島素分泌輕度下降,血糖上 升。目前健保局規定要經過手術或放射治療後,仍無法將生長素和 IGF-1 的濃度控制到正常,才可使用,因此不能作為第一線治療。目前國內上市的體抑素類似物有前二種:
1. Sandostatin (octreotide):它是體抑素的八肽類似物。Octreotide比體抑素 抑制生長素的效力及特異性明顯增高,且作用時間顯著延長。廣泛的臨床證實使用 octreotide 來治療肢端肥大症的療效顯著,手術後及放射治療後,對病情控制 仍不佳的病人帶來希望。開始劑量為50 µg,皮下注射,每12小時1次,而後漸增至 100µg,每日 2-3次。過去皮下注射octreotide, 一天三次,甚不方便,現有長效 劑型的octreotide LAR (Sandostatin LAR 10, 20, 30 mg) 每月肌肉注射 一次,是病人的一大福 音。也有研究顯示 Sandostatin LAR 可直接作為第一線的治療 。
2. Somatuline (lanreotide):它是一種新、長效型體抑素類似物,能抑制生長素的分泌。是一種緩慢釋放型的藥 物,可避免重複肌肉注射或持續給藥 的不便。現有Somatuline Autogel 60, 90, 120 mg, 每月皮下注射一次,從中等劑量開始使用,視病人的狀況調整。
3. Pasireotide (SOM230):其主要和 SST1-3 和 SST5 結 合, 親 合 力 比 octreotide 和 lanreotide 強,目前還在藥物實驗階段 。
(三) Pegvisomant (Somavert 10, 15, 20 mg): 是一種生長素受體拮抗劑,作用在周邊組織,阻止生長素和其受體結 合,抑制生長素的活性和減少 IGF-1 的產生。因無法抑制生長素的分泌作用,因此無法使用生長素的濃度來評估療效。Pegvisomant 皮下注射每日一次,90% IGF-1 的濃度可恢復正常,但少數病人的腫瘤變大。其副作用則會造成肝指數升高,甚至變成肝炎 。
二、手術治療
應作為首選,隨著經蝶竇垂體腺瘤切除術的進展、立體定
位等治療技術的運 用,使得外科手術 的治癒率、安全性也獲得提升,手術併發症和 術後垂體功能損傷也
會相對減少,治癒率約40-70%。手術可直接看到腫瘤組織,並避開視交叉和視神經,可將腫瘤完全切除;蝶鞍內小腺瘤(

三、放射治療
適用於手術後、但仍有殘餘腫瘤的輔助治療,或疾病早期腫瘤較小、無視野缺損和 壓迫症狀時,防止腫瘤細胞生長,減少生長素的合成和分泌。放射治療的缺點是不能迅速使腫瘤縮小,改善視力。放射治療包括常規高電壓照射,總量 45-50 Gy,每周5 次,共 4-5 周,治癒率約為 50-60%,平均需要7-10 年生長素的濃度才能恢復正常,緩不濟急。在等待治療發揮效果的時間,可以併用 藥物治療。放射治療的副作用包括:垂體 功能低下、視神經損傷、增加腦血管病變,甚至誘發惡性病變,80-100%病人的副作用在10-15 年內發生。α 粒子照射需要有迴旋加速器,劑量約90 Gy,可使小腺瘤和大腺瘤分別經3年和5年後,才會使血漿生長素的濃度< 5 ng/mL,垂體功能低下症約見於一半的病 人。質 子刀放射 手術 (proton-knife) 可提供120 Gy,三分之一的病人可在2年內,使生長素的濃度< 5 ng/mL,但平均2-8 年後,可能發生垂體 功能低下症。伽瑪刀(g-knife) 為立體定位放療,適用於垂體小病變,可防止視交叉、視神經和海綿竇結構的損傷。其他併有垂體功能低下、甲狀腺 高能症、糖尿病、尿崩症等症 狀的病人,應採用個別症狀治療。嚴重頭痛者,也可給予適當的止痛、鎮靜劑,但須儘量避免 給予可能造成成癮的藥物。
預後
肢端肥大症的病人如果沒有接受任何治療,預後較差,且死亡率較高 ,顯然死亡率與併發症的增多有關,平均壽命減少10年,主要是因心血管疾病。在二個統合分析中,肢端肥大症的死亡率是正常人的1.72倍,但如果提早診 斷和有效治療,其死亡率和預後,則會有所改善。高濃度的生長素或 IGF-1、高血壓或心肌病變 都是不好的預後。其它如症狀出現的早晚、糖尿 病、血脂、癌症 等相關性則較小,肢端肥大症的治療結果 ( 表一 ) 。
結論
肢端肥大症的病人除了造成外貌的改變,也會增加心血管、呼吸系統、新陳代謝等 問題和增加腫瘤的發生率。由於大部份的病人,無法經由一次手術完全根治,仍須長期追蹤和治療,因此病人如可互相鼓勵,互相照料和關心,則會 使人生更有自信。為此國內有「大肢俱樂部」的產生,「大肢俱樂部」是民國82年7月3 日由台大醫院所成立的團體,同時也設立了聯絡網站,網址是http://www.acromegaly.com.tw。另外目前經由中華民國內分泌學會執行台灣肢
端肥大症病人的登錄,可以了解台灣對此類病人照顧的情形,並作為未來政策的參考。