糖原贮积病(GSD)是一组罕见的单基因遗传病,以糖原生成(糖原合成)、糖原分解(糖原通过葡萄糖-6-磷酸(G6P)分解为葡萄糖)或糖酵解(葡萄糖转化为丙酮酸盐)障碍为特征的疾病。这些复杂、异质性的多器官疾病在表现、临床和生化表型以及治疗方面有很大差异。根据受累的原发系统,GSD可大致分为肝GSD和肌GSD。
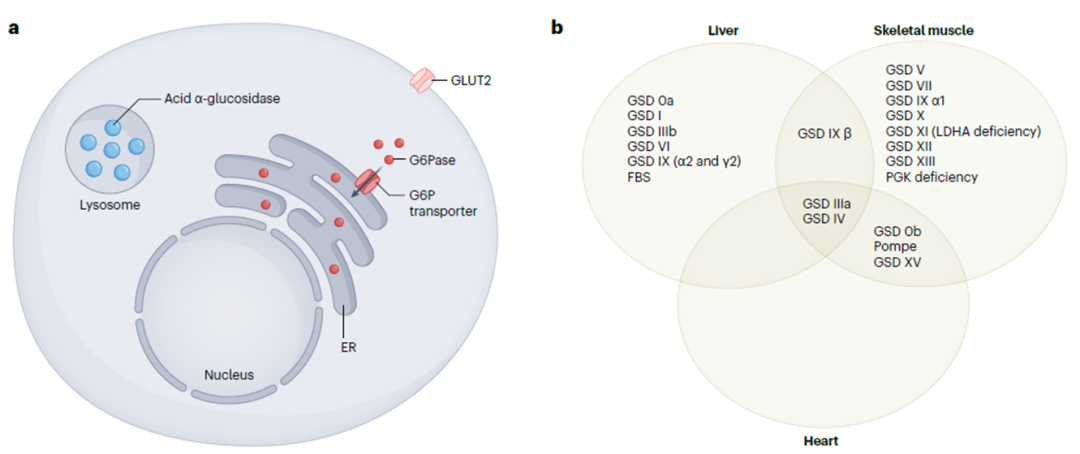 GSD的细胞生物学和受累器官 PMID: 37679331
GSD的细胞生物学和受累器官 PMID: 37679331
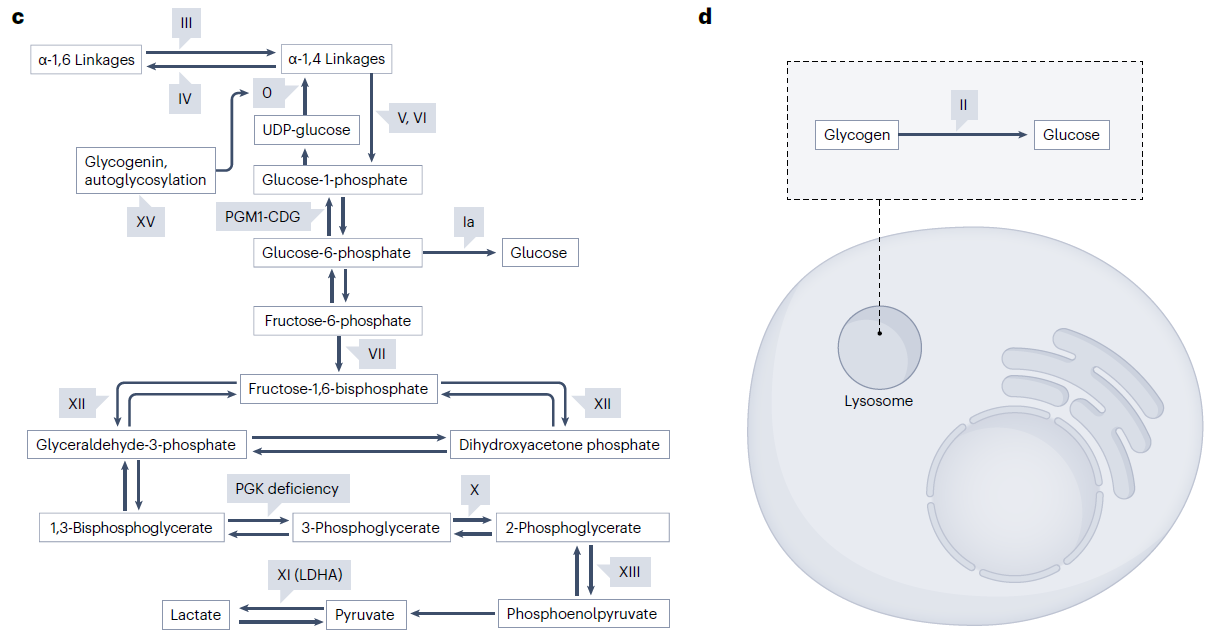
GSD涉及糖生成(GSD 0、GSD IV、GSD XV)、糖原分解(GSD I、GSD III、GSD V、GSD VI和GSD IX)、糖酵解(GSD VII、GSD X、GSD XI和GSD XII)和糖异生(GSD I)的缺陷。糖原1是自身糖基化,并提供了糖原合成酶作用的引物(糖原1缺乏与GSD XV相关)。
糖原贮积病II型(GSDII),也称为庞贝病(Pompe disease, PD),是一种常染色体隐性遗传病,由酸性α-葡萄糖苷酶(acid alpha-glucosidase enzyme, GAA)缺乏引起,GAA是溶酶体中糖原水解为葡萄糖的原因。
传统上,庞贝病根据发病年龄、器官受累(即是否存在心肌病)、严重程度和进展速度分为两种主要表型——婴儿发病庞贝病 (IOPD) 和晚发型庞贝病 (LOPD)。一般来说,表现越早,进展速度越快;因此,IOPD 和 LOPD 这两种一般分类往往在临床上有助于确定预后和治疗方案。
尽管 LOPD 分为儿童期、青少年期和成人期发病,但许多成人发病的个体回忆起从儿童期开始的症状,因此,对于 12 个月后就诊的患者,迟发性通常是首选术语。最有可能的是,LOPD 代表了一个临床连续体,其中发病年龄无法可靠地区分亚型。
IOPD在子宫内可能很明显,但在中位年龄为4个月时更常被识别为肌张力减退、全身肌无力、喂养困难、生长迟缓和呼吸窘迫。喂养困难可能是由面部肌张力减退、巨舌、舌头无力和/或口运动技能差引起的。听力损失很常见,可能反映了耳蜗或传导病变或两者兼而有之 。
|
体征
|
比例
|
|
肌张力减退/肌无力
|
52-96%
|
|
心脏扩大
|
92-100%
|
|
肝肿大
|
29-90%
|
|
左心室肥厚
|
83-100%
|
|
心肌病
|
88%
|
|
呼吸窘迫
|
41-78%
|
|
(心脏的)杂音
|
46-75%
|
|
舌头肿大(巨舌)
|
29-62%
|
|
喂养困难
|
57%
|
|
发育迟缓
|
53%
|
|
深部腱反射消失
|
33-35%
|
|
正常认知
|
95%
|
如果不进行酶替代疗法治疗,可能在出生后最初几周通过超声心动图发现的心肥大和肥厚型心肌病会进展为左心室流出道梗阻。心脏增大还会导致肺容量减少、肺不张,有时还会导致支气管压迫。糖原的进行性沉积导致传导缺陷,如心电图上 PR 间期缩短所见。
在未经治疗的婴儿中,通常在出生后的头两年因心肺功能不全而死亡。
LOPD可表现为不同年龄段的肌无力和呼吸功能不全。疾病进展通常由发病年龄预测,因为如果症状在儿童期明显,则进展更快。
虽然儿童晚期至青少年发病的庞贝病的初始表现通常不包括心脏并发症,但一些患有晚发性疾病的成人患有动脉病变,包括胸主动脉升主动脉扩张 。值得注意的是,仅超声心动图(不特异性测量胸主动脉直径)可能不足以显示这种并发症。此外,颈内动脉扩张可能与临床体征有关,例如短暂性脑缺血发作和第三神经麻痹。
骨骼肌受累的进展比婴儿形式慢,最终累及横膈膜和辅助呼吸肌。受影响的人经常因为下肢无力而成为轮椅使用者。呼吸衰竭是主要发病率和死亡率的原因。男性、骨骼肌无力的严重程度和病程都是严重呼吸功能不全的危险因素。
LOPD 可能在出生后的第一个十年至第七个十年出现,表现为主要累及下肢的进行性近端肌无力,如肢带型肌营养不良症或多发性肌炎。受影响的成年人通常描述从儿童时期开始的症状,导致难以参与运动。后来,疲劳和难以从坐姿站起来、爬楼梯和走路时,需要及时就医。在未经治疗的 LOPD 患者队列中,诊断时的中位年龄为 38 岁,诊断后的中位生存期为 27 年,死亡时的中位年龄为 55 岁(范围为 23-77 岁)。
成人 LOPD 患者晚期骨质疏松症的证据正在积累;虽然这在很大程度上可能继发于行走减少,但其他病理过程也不容忽视。
LOPD 的临床表现:
-
进行性近端肌无力 (95%)
-
呼吸功能不全
-
运动不耐受
-
劳力性呼吸困难
-
端坐呼吸
-
睡眠呼吸暂停
-
脊柱前凸和/或脊柱侧弯
-
肝肿大(儿童期和青少年期发病)
-
巨舌症(儿童期发病)
-
咀嚼和吞咽困难
-
胃肠道症状,包括肠易激样症状
-
慢性疼痛
-
呼吸道感染增加
-
深部腱反射减弱
-
高尔征
-
关节挛缩
电生理学检查:肌病可以通过肌电图 (EMG) 记录在所有形式的庞贝病中,尽管某些肌肉可能看起来正常。在成人中,可能需要脊柱旁肌肉的针头肌电图来证明异常 。
运动神经和感觉神经的神经传导速度检查是正常的,尤其是在 IOPD 和 LOPD 的诊断时。然而,在患有 IOPD 的儿童中已证实存在一种不断发展的运动轴突神经病变 。
肌肉活检:与其他糖原贮积症相比,庞贝病也是一种溶酶体贮积病。在庞贝病中,糖原储存可以在肌肉细胞的溶酶体中观察到,作为不同严重程度的液泡,用高碘酸 - Schiff 染色呈阳性。然而,20%-30% 的 LOPD 患者有部分 GAA 酶缺乏症,可能不会表现出这些肌肉特异性变化。此外,虽然肌肉中糖原储存的组织化学证据支持糖原储存障碍,但它对庞贝病并不具有特异性。
庞贝病的发病率因种族和地理区域而异,从非裔美国人的 1:14,000 到欧洲血统的 1:100,000 不等。
人口
|
流行率
|
非裔美国人
|
1:14,000 |
荷兰
|
1:40,000
|
| 美国 |
1:40,000
|
| 中国华南地区/台湾 |
1:50,000
|
| 欧洲血统 |
1:100,000 婴儿发病
1:60,000 迟发 |
| 澳大利亚 |
1:145,000 |
葡萄牙
|
1:600,000 |
GAA基因(OMIM *606800)位于染色体17q25上,是在线Mendelian Inheritance in Man Database中唯一与庞贝病(OMIM #232300)相关的基因。GAA 的长度约为 20 kb,包含 20 个外显子。cDNA 长度超过 3.6 kb,具有 2859 个编码序列的核苷酸。导致 GAA 酶活性完全缺失的致病变异组合在婴儿发病庞贝病 (IOPD) 中更常见,而导致部分酶活性的致病变异组合通常更常见于迟发性庞贝病 (LOPD)。
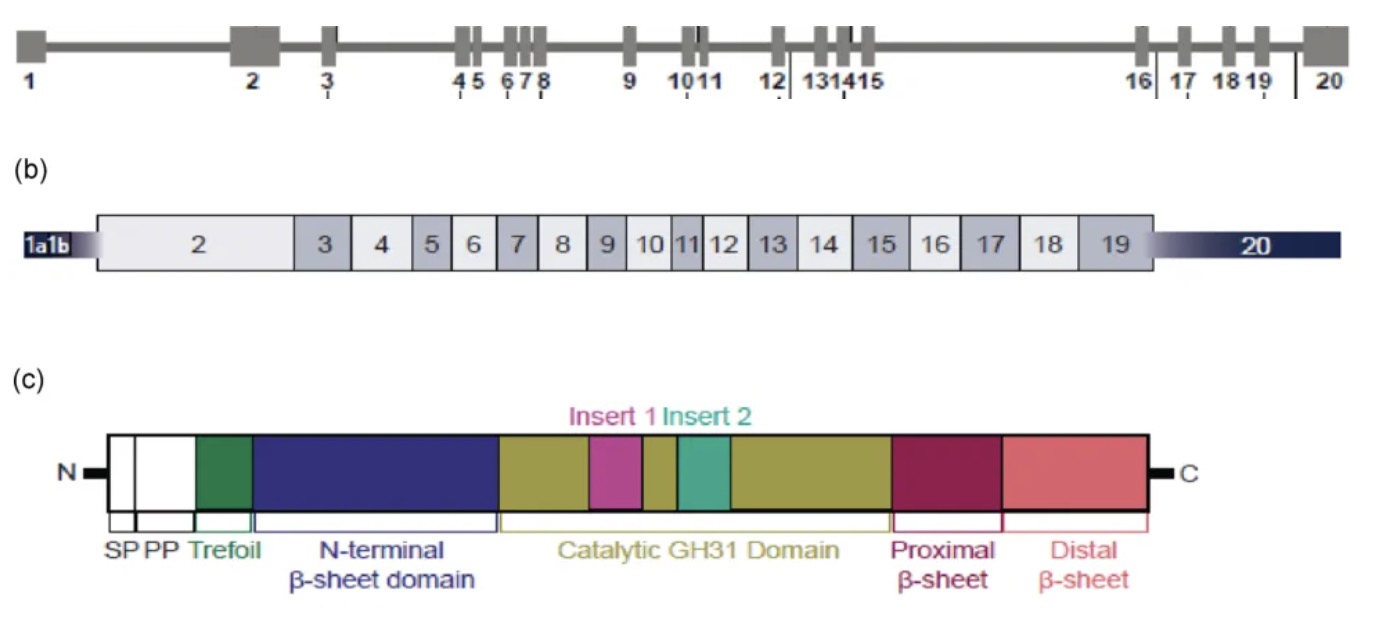 正常基因产物:GAA 是一种溶酶体酶,可在酸性 pH 值下催化 α-1,4- 和 α-1,6-葡萄糖苷键。有七个糖基化位点。未成熟蛋白质由 952 个氨基酸组成,预测的非糖基化重量为 105 kd。成熟酶以 76-kd 或 70-kd 形式作为单体存在。
异常基因产物:GAA致病变异导致 mRNA 不稳定和/或酸性 α-葡萄糖苷酶或活性显著降低的酶严重截短。
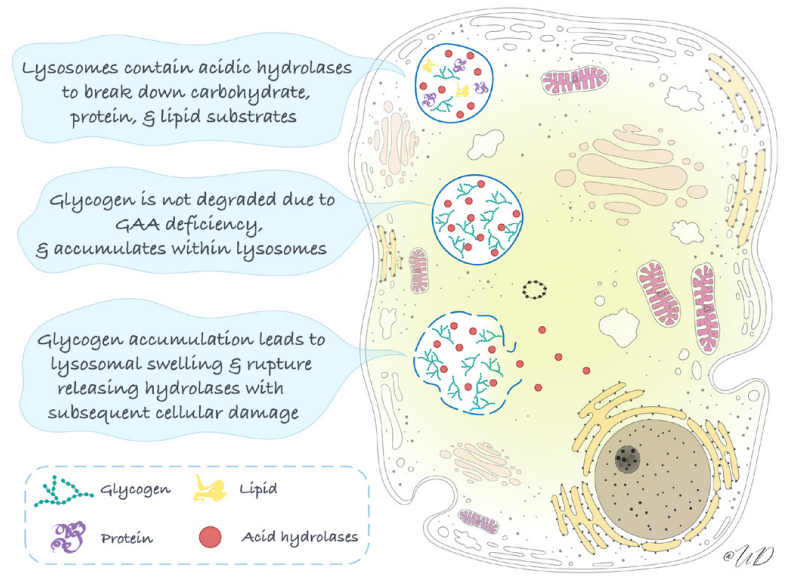
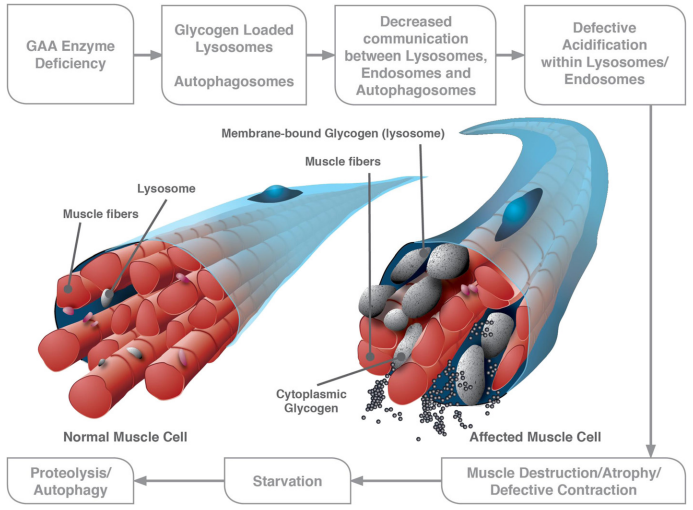
由于自噬-溶酶体途径在大分子的降解、回收磨损的细胞器、去除有毒物质和细胞适应各种应激中起着至关重要的作用,功能失调的自噬会导致远远超出进行性糖原积累的一系列事件。涉及的器官系统包括:心脏(肥厚型心肌病)、骨骼肌(肌张力减退、肌肉力量下降、运动迟缓、巨舌和 II 型呼吸衰竭)、平滑肌(喂养困难)、肝脏(肝肿大和肝细胞损伤)和中枢神经系统(生理性疲劳)。这些症状通常在婴儿期表现出来,表现为 IOPD,这是 PD 谱系中最严重的形式。一般来说,疾病严重程度与残留 GAA 活性呈负相关,IOPD 的中位临床发病年龄为 1.6 个月。肌肉是导致肌张力低下和肌无力的最突出受累器官,PD病也被归类为代谢性肌病。由于全身肌张力低下和呼吸肌无力,患有PD病的婴儿更容易发生肺部感染,这是在指示患者中观察到的突出临床表现。
GAA基因突变导致溶酶体酶GAA缺乏,导致溶酶体和非溶酶体糖原在多个组织中积累。溶酶体增大和破裂以及自噬积累导致该疾病的进行性肌病,自噬积累导致 LOPD 中的骨骼肌破坏。
正常基因产物:GAA 是一种溶酶体酶,可在酸性 pH 值下催化 α-1,4- 和 α-1,6-葡萄糖苷键。有七个糖基化位点。未成熟蛋白质由 952 个氨基酸组成,预测的非糖基化重量为 105 kd。成熟酶以 76-kd 或 70-kd 形式作为单体存在。
异常基因产物:GAA致病变异导致 mRNA 不稳定和/或酸性 α-葡萄糖苷酶或活性显著降低的酶严重截短。
由于自噬-溶酶体途径在大分子的降解、回收磨损的细胞器、去除有毒物质和细胞适应各种应激中起着至关重要的作用,功能失调的自噬会导致远远超出进行性糖原积累的一系列事件。涉及的器官系统包括:心脏(肥厚型心肌病)、骨骼肌(肌张力减退、肌肉力量下降、运动迟缓、巨舌和 II 型呼吸衰竭)、平滑肌(喂养困难)、肝脏(肝肿大和肝细胞损伤)和中枢神经系统(生理性疲劳)。这些症状通常在婴儿期表现出来,表现为 IOPD,这是 PD 谱系中最严重的形式。一般来说,疾病严重程度与残留 GAA 活性呈负相关,IOPD 的中位临床发病年龄为 1.6 个月。肌肉是导致肌张力低下和肌无力的最突出受累器官,PD病也被归类为代谢性肌病。由于全身肌张力低下和呼吸肌无力,患有PD病的婴儿更容易发生肺部感染,这是在指示患者中观察到的突出临床表现。
GAA基因突变导致溶酶体酶GAA缺乏,导致溶酶体和非溶酶体糖原在多个组织中积累。溶酶体增大和破裂以及自噬积累导致该疾病的进行性肌病,自噬积累导致 LOPD 中的骨骼肌破坏。
婴儿发病的庞贝病 (IOPD)
鉴别诊断中应考虑的疾病:
-
脊髓性肌萎缩症 1(Werdnig-Hoffman 病,SMA I)的特征是肌张力减退、喂养困难、进行性近端肌无力和反射消失;无心脏受累。SMA I 是由 SMN1 中的双等位基因致病变异引起的。遗传是常染色体隐性遗传。缺乏心脏扩大应有助于鉴别 SMA1 和 IOPD。
-
Danon病的特征是肌张力减退、肥厚型心肌病和糖原储存过多导致的肌病;它是由男性的半合致病性 LAMP2 变异和女性的杂合致病性 LAMP2 变异引起的。继承是 X 链接的。男性比女性受影响更严重,心肌病和肌无力的典型发病年龄是在青春期中期,但也有少数婴儿发病的报道。此外,还可能存在智力障碍,这在庞贝病中是罕见的。
-
肉碱摄取障碍 (OMIM 212140) 的特征是肌无力和心肌病,但血清 CK 浓度升高;它是由SLC22A5的双等位基因致病变异引起的。遗传是常染色体隐性遗传。表型差异很大,包括通过新生儿筛查确定的无症状妇女。有急性症状的婴儿可能有脑病或昏迷,这在庞贝病中并不常见。
-
IIIa 型糖原贮积病(去分支缺乏症)的特征是肌张力减退、心脏肥大、肌无力和血清肌酸激酶浓度升高,肝脏受累比庞贝病中常见的更明显。它是由 AGL 中的双等位基因致病变异引起的。遗传是常染色体隐性遗传。
-
糖原贮积病 IV 型(分支酶缺乏症)的特征是肌张力减退、心脏肥大、肌无力和血清肌酸激酶浓度升高,肝脏受累比庞贝病(类似于 GSD IIIa)更明显。它是由 GBE1 中的双等位基因致病变异引起的。遗传是常染色体隐性遗传。
-
肥厚型心肌病的特征是双心室肥厚,无肌张力减退或明显的肌无力。请参阅肥厚型心肌病概述。
-
心肌炎的特征是心肌炎症导致心脏扩大,但无肌张力低下或肌无力。
-
线粒体/呼吸链疾病的临床表现差异很大,可能包括肌张力减退、呼吸衰竭、心肌病、肝肿大、癫痫发作、耳聋和血清肌酸激酶浓度升高。它们通常与庞贝病区分开来,即无肌张力减退和认知受累。请参阅线粒体疾病概述。
迟发性庞贝病 (LOPD)
呼吸肌的早期受累通常有助于鉴别青少年发病的庞贝病和许多神经肌肉疾病。
鉴别诊断中应考虑的疾病:
-
肢带性肌营养不良症。进行性肌无力见于腿部、骨盆和肩部;保留躯干肌肉。遗传是常染色体隐性遗传,或较少见的常染色体显性遗传。
-
Duchenne-Becker 肌营养不良症。可见进行性近端肌无力、呼吸功能不全和行走困难;这种疾病主要影响男性。它是由男性的半合子DMD致病变异引起的。继承是 X 链接的。
-
多发性肌炎的特征是进行性、对称性、不明原因的肌无力。
-
V型糖原贮积病(McArdle病;肌糖原磷酸化酶缺乏症)。血清肌酸激酶浓度升高和劳累时肌肉痉挛。PYGM中的双等位基因致病变异是致病因素。遗传是常染色体隐性遗传。
-
糖原贮积病VI型。可见肌张力减退、肝肿大、肌无力和血清肌酸激酶浓度升高。PYGL 中的双等位基因致病变异是致病因素。遗传是常染色体隐性遗传。
庞贝病的诊断
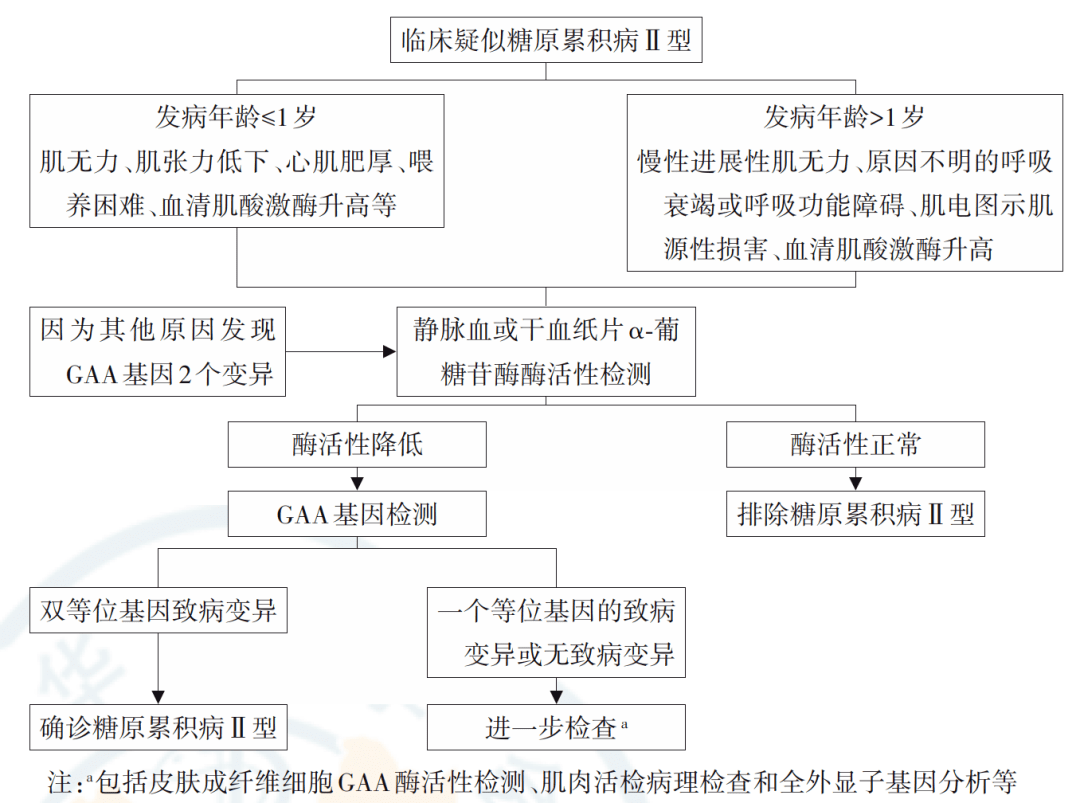
庞贝病的临床诊断通常延迟数月或数年,因此,新生儿筛查为早期诊断和治疗提供了机会,尤其是对于IOPD。GAA酶活性测定作为庞贝病诊断的一线方法,如果酶活性低或处于临界状态,则需要进行遗传分析。由于庞贝病是一种常染色体隐性遗传病,因此受累患者的基因分析显示纯合突变或复合杂合突变。众所周知,突变在整个GAA中散布存在,因此,需对整个基因进行测序。如果 GAA 酶活性低,并且测序显示杂合致病变异或VUS 变异,则应通过 GAA 的 MLPA 分析完成遗传研究,以排除多个核苷酸的缺失或插入,或其他扩展的遗传分析。在酶活性低和 2 种不同致病变异的患者中,重要的是通过对亲属的分离研究来确认复合杂合性,以证明这两个突变位于两个不同的等位基因中。
成人晚发型庞贝(LOPD)的诊断流程图 PMID: 30704229
尽管目前庞贝病仍无法治愈,但随着医学技术的进步与发展,已寻找到一些有效改善患者临床症状的方法。多项庞贝病的研究证明,接受酶替代治疗(enzyme replacement therapy,ERT)的庞贝病患者生存率、心脏功能、生长发育、呼吸功能、运动能力及生活质量等方面均有获益。近年来,庞贝病的新特异性治疗方法层出不穷,新一代ERT药物(avalglucosidase alfa)已在美国和欧盟获批,此外基因治疗领域亦取得较大进展。
如果家族中有类似病例的高危人群或曾经分娩过庞贝病孩子的家庭,应接受遗传咨询,夫妻双方在孕期及时进行基因诊断,尽早发现胎儿异常,做出有效干预。
 GSD的细胞生物学和受累器官 PMID: 37679331
GSD的细胞生物学和受累器官 PMID: 37679331