
前 言 《患者社群组织如何推动药物研发——全球经验》报告由蔻德罕见病中心(CORD)于2019年9月正式发布,主编黄如方先生携手林宁航先生、曹文东先生等16 位项目研究员联合编著。本报告在深圳举办的第八届中国罕见病高峰论坛开幕式上首次正式发布。 报告全书近十万字,分为五个篇章,通过系统研究全球患者组织参与促进药物研发的现状和经验,为推动我国患者组织与监管部门、科研人员及医药产业界在药物研发方面建立合作提供了一份详实、严谨、客观的指导参考意见。 蔻德罕见病中心创始人、主任黄如方先生在报告前言部分指出:“中国的患者社群组织面对着起步晚、数量少、组织化专业化程度低、社会资源有限等挑战,在参与促进药物研发方面,我们中国患者组织的能力和欧美国家相比仍然有着不少差距。但CORD团队,早在8年前就已经开始了中国患者社群组织的孵化和培育工作,这个工作是卓有成效的,我们已经看到有越来越多的患者社群组织成立并发展起来,在基础研究、临床研究及药物研发等方面都在做积极的尝试。但我们也看到,长期以来中国的医疗行业从业者,对患者社群组织的价值是缺乏重视的,甚至存有偏见。 《患者社群组织如何推动药物研发——全球经验》这一研究报告旨在为患者组织赋能、为医疗行业从业者消除偏见、为政策制定者提供参考,也希望能够以此引起对这一话题更多的讨论。” “罕见病信息网”公众号将独家展开全文连载,敬请读者关注和转发。本文连载涉及相关政策梳理、数据统计及国内外进展等内容截止到2019年7月,其他有任何错误及不足之处,请读者不吝赐教。
Part.1 罕见病概述 国际上罕见病的介绍和定义 罕见病是指发病率低、病情一般较为严重、诊断治疗较为复杂的疾病。目前全球罕见病约有7000~8000种,约有3.5亿人受其影响。80%的罕见病是遗传性疾病,50%的罕见病通常于患者儿童时发病,且这些罕见病会严重影响儿童的寿命和生存质量。然而,全球目前只有10%的罕见病患者能够得到治疗。 罕见病本质上是一种社会定义,是一个相对概念,在时间的维度里是可变的可被重新定义的社会认知。随着人类对疾病的研究逐渐深入,有些罕见病可能会成为常见病,每年也都有新的罕见病例被报道。所以,在全球层面,并没有一个统一且被普遍接受的对罕见病的定义。 目前比较主流的定义有: · 欧洲议会和委员会于1999年12月16日颁布了《孤儿药条例(EC)141/2000》 。该法规定义了罕见病是患病率低于5/10,000的慢性、渐进性且威胁生命的疾病。 · 美国于2002 年通过的《罕见病法案》将罕见病定义为在美国患病人数低于20 万人的疾病。 · 日本将患病人数少于5万(或发病人口比例小于1/2500)的疾病定义为罕见病,并制定了罕见病目录 。 · 中国台湾省于2000年通过《罕见疾病防治及药物法》将患病率在0.1‰以下的疾病,或在特殊情况下经“卫生署”认定并公告的疾病定义为罕见病。 这些国家或地区在立法基础上制定了一系列关于激励研发、药物可及性、药物可支付性、患者权益保障等方面的措施。英国、澳大利亚等国家虽没有相关立法但也针对罕见病患者采取了一些积极的措施。 随着科技的进步和整个社会对于罕见病的不断认识,越来越多的国家也出台了罕见病的定义,为罕见病的保障相关政策与法规提供依据,比如: · 在2015年9月,菲律宾罕见病法案出台。该法案对于罕见病的定义为:罕见疾病是指遗传性代谢紊乱和其他类似的患病率小于1/20,000的疾病。这些疾病需经菲律宾国家卫生研究所(National Institute of Health)的推荐并需要被菲律宾卫生部(Department of Health)认定。 · 俄罗斯对于罕见病的定义是患病率低于1‰的疾病。2011年11月21日出台的联邦法律N° 323-FZ的44款中明确提出要对遭受罕见病的俄罗斯联邦居民进行医疗方面的关注。 · 巴西对罕见病的定义是患病率小于0.65‰的疾病。 中国罕见病目录
中国对于罕见病目录的探索始于2016年。原上海市卫生健康委员会于当年发布了国内首个主要罕见病目录——《上海市主要罕见病名录(2016版)》,包含56种罕见病,同年9月23日,蔻德罕见病中心(Chinese Organization for Rare Disorders, CORD)发布了《中国罕见病参考名录》,包含了147种罕见病。2018年5月22日,中国国家卫生健康委员会、科技部、工信部、国家药监局、国家中医院管理局五部委联合制定并发布了《第一批罕见病目录》(以下简称“中国罕见病目录”)。该目录以优先收录“发病率相对较高、疾病负担较重、可治性较强的罕见病”为主要标准,囊括了白化病、肌萎缩侧索硬化、戈谢病、卡尔曼综合征、马凡综合征、法布雷病、血友病等121种疾病,其中包含了《上海市主要罕见病名录(2016版)》中的50种以及《中国罕见病参考名录》中的88种。该目录供各部门在工作中参考使用,有助于加强中国罕见病管理,提高罕见病诊疗水平,维护罕见病患者健康权益。并为中国国家食品和药品监督管理总局于2017年10月发布的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》中提及的“罕见病目录”的界定给出了明确的范围。国家级罕见病目录的出台打破了中国罕见病“无官方定义,无专项政策支持,无医保报销”的三无状态,为提升全社会对罕见病的认识,提高临床一线医务工作人员罕见病诊疗能力,出台罕见病用药研发上市激励政策,增强罕见病药品可支付性等方面提供了切实的依据。同时,基于国际统一共识的罕见病分类标准,也推动了罕见病领域国际临床试验药物研究和罕见病保障政策的国际合作。 2018年5月28日,中国国家卫生健康委员会医政医管局发布了《关于印发罕见病目录制订工作程序的通知》。《罕见病目录制订工作程序》以促进罕见病目录更加科学合理的制订,该工作程序提出“目录的制订坚持从我国国情出发,充分结合经济发展、人口情况、社会保障水平等因素,并参考与我国社会发展水平相近国家或地区的管理经验”;“分批遴选目录覆盖病种,对目录进行动态更新。目录更新时间原则上不短于2年。”纳入目录的病种应当满足下列条件:(一)国际国内有证据表明发病率或患病率较低;(二)对患者和家庭危害较大(三)有明确诊断方法;(四)有治疗或干预手段、经济可负担,或尚无有效治疗或干预手段、但已纳入国家科研专项。 中国至今没有官方制定的罕见病定义。中华医学会遗传学分会于2010年5月召开的中国罕见病定义专家研讨会上将患病率<1/500,000或新生儿发病率<1/10,000的疾病定义为罕见病。然而由于该定义与国际普遍定义差距较大,并且将大量罕见病排除在外,因此该定义具有较大争议性。由于目前中国关于罕见病的流行病学数据十分匮乏,所以基于现实情况制定罕见病目录可能是较为可行的方案。 罕见病药物近况
罕见病药物可及性的主要障碍有:对于特定疾病没有有效和安全的治疗方法;当有疗法时,也会出现下列情况:其临床关联度和成本效果不明,医务人员缺乏相关知识和训练,缺乏相应诊断体系以及过高的药品价格。本章暂不讨论罕见病药物的可支付性(Affordability)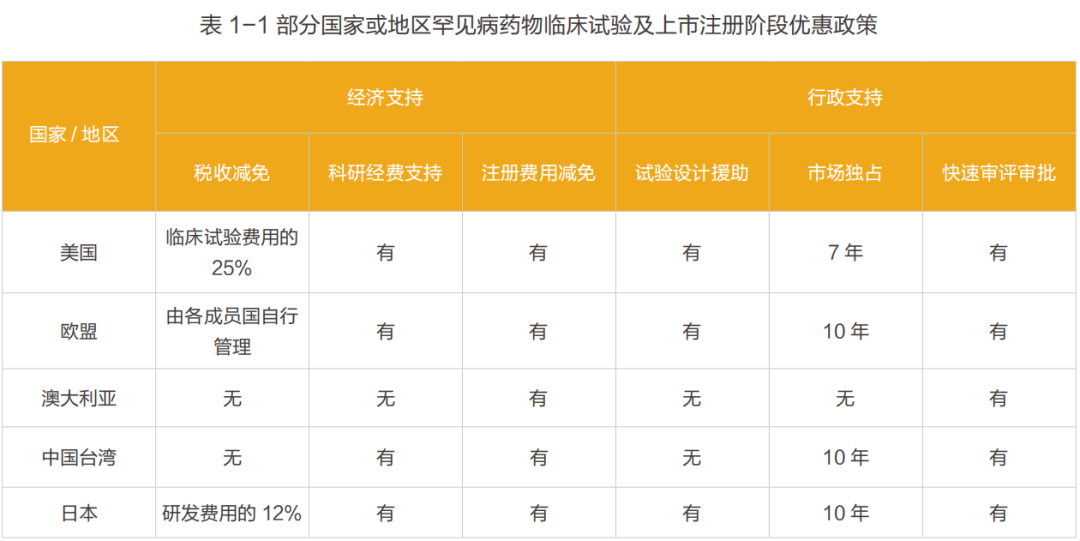
国际上,最早针对于罕见病药品的法律法规是美国于1983年出台的孤儿药法案(The Orphan Drug Act of 1983,ODA)。主要要素见表1- 2。 从1983年至2018年6月,FDA共接收了7,394件孤儿药认定申请,每年的申请数量从 1983年的16件增长至2017年的715件。一共有731种认定并通过的罕见病以及503种获得孤儿药认定的疗法。 在欧洲,欧洲议会和委员会于 1999年12月16日颁布了《孤儿药条例(EC)141/2000》 。该法规定义了罕见病是患病率低于5/10,000的慢性、渐进性且威胁生命的疾病。从2000年至2018年,欧洲药品管理局(European Medicines Agency, EMA)共受理了孤儿药认定申请3210件,获得孤儿药认定的药品共2121种(成人用药占31%,儿童用药占12%,可用于成人和儿童的药品占57%),在提交后撤销的申请共876件。截止2018年12月,在中国《第一批罕见病目录》中共计有74种罕见病是“有药可治的”,即在美国或欧盟、日本有药物针对这74种罕见病的适应症(Indications)获批上市。这74种罕见病已在美国或欧盟、日本上市162种治疗药物(以化学分子为计入单位),涉及197次适应症获批(以治疗药物适应症获批数量为计入单位,若一种化学分子有多个不同适应症获批,则重复计入)。 (2)中国罕见病药物的可及性情况 中国对于罕见病的关注起步较晚,目前国家层面尚没有专门的罕见病法律及政策法规,也缺乏专门的罕见病药品(孤儿药)政策。目前现行与罕见病及罕见病药物相关的政策见表 1- 3。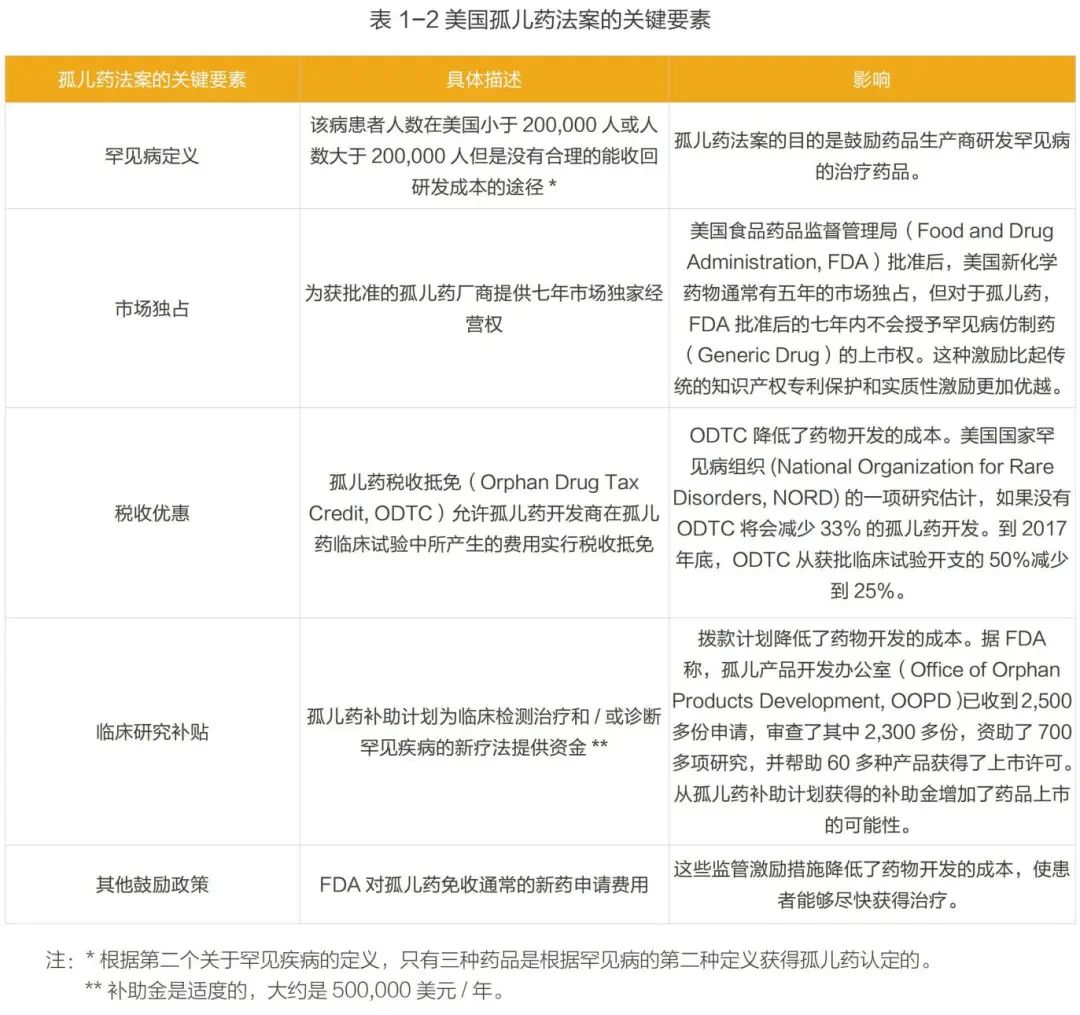
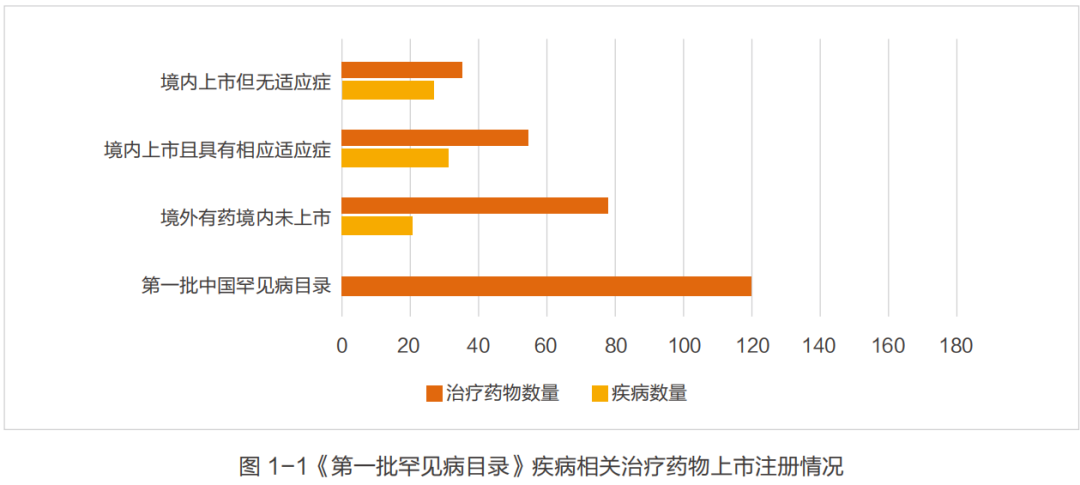
尽管国家出台了众多政策,但是中国的罕见病药物可及性仍然不容乐观。已在美国上市的近 400种孤儿药超4成未在国内申报。因全球缺乏统一的罕见病定义,而国内尚没有明确的罕见病定义,因此CORD以2018年《第一批罕见病目录》为样本,对目录所列的121种疾病全球药物进行梳理(图1- 1)。从结果看,121种疾病中,有47种疾病境外(主要指美国 / 欧盟 / 日本)也没有治疗药物,在境外有药但国内未上市的有79种药物,涉及21种疾病;在已上市的药品中仍有35种药无适应症。整体上已上市的罕见病药品数量与欧美仍有较大差距。在境外上市的162 种罕见病治疗药物中,有83种(51%)已在中国上市,涉及53种罕见病。然而,在我国明确注册罕见病适应症的药物仅有55种,涉及31种罕见病。 值得注意的是, 2018年有13种罕见病药物涉及10种罕见病通过优先审评审批成功申请上市。有20种罕见病药物涉及12种罕见病纳入 2018 年国家药品监督管理总局药品审评中心发布《临床急需境外新药名单(第一批)》。2019年,又有14种罕见病药物纳入《临床急需境外新药名单(第二批)》。截至2019年7月1日,《临床急需境外新药名单(第一批)》中涉及《第一批罕见病目录》中所包含疾病的20种罕见病用药,只有4种上市。
促进中国罕见病新药研发的重要性
目前全球 90% 的罕见病还没有有效的诊疗方法,市场空缺极大。根据国内外罕见病药品的上市情况的比对,我国罕见病药品相对较为短缺且主要依赖进口,这些进口药物价格高昂,国家对罕见病的治疗费用尚无保障政策,大量患者无力承担。而我国庞大的人口基数注定了规模较大的罕见病患者群体。根据石鑫淼等人的研究,2014-2015年96家三甲医院中,罕见病例次占到同期住院总例次的0.35%。另据估计,中国罕见病患者人数约为1,680万。鉴于罕见病的异质性较大,各罕见病患病率不一,在各个人种中患病率也不尽相同,这就注定了我国必须开始和加快罕见病用药新药的研发以惠及更多的国内罕见病患者。有药可治是切实保证罕见病患者这一弱势群体的第一步。 绝大多数罕见病的发病机制、诊疗方法不明确,并且罕见病病例少,患者分散,数据采集困难,往往无法引起社会各界对其重视,制药企业对罕见病用药往往抱有“收益不确定”的担忧,通常缺乏研发、仿制及生产罕见病用药的动机。即便药企具备了研发生产罕见病用药的动机,罕见病患者数量极少也导致了传统的随机对照临床试验(Randomized Controlled Trial, RCT)的可行性比较差。较大的研发难度直接导致了罕见病患者的健康权难以得到保障,在当下我国罕见病药品政策仍处于窗口期的阶段,加大力度促进国内罕见病用药的研发,无疑是一个黄金时期。 同时,支持本土罕见病新药的研发,才能确保创新药的国内定价权,是对我国未来医药产业具有战略意义的。针对罕用药的基础和临床研究不仅促进了罕见病诊断和治疗技术的发展,还有助于一般常见疾病的发病机制研究和药物研发。当前中国医药产业特别是生物制药领域正处于高速发展时期,罕用药的研发和生产却刚刚起步。促进罕见病用药研发的受益者不仅是广大患者还包括处在成长阶段迫切需要各种资源支持的生物科技公司以及整个制药行业和生物行业。本土创新研发必定也会提升我国医学的研究能力,符合《健康中国 2030》提出的战略目标。


印刷版报告 全文报告将于近期连载发布。