
背景
无药可治的罕见病促使孤儿药法案通过
约3000万美国人患7000种罕见疾病,其中仅5%左右的罕见病有FDA批准的疗法。法规定义罕见病为影响不到20万人的疾病。1983年之前,罕见病的药物稀少,或者根本没有。鉴于要符合FDA对药品安全性和有效性标准的要求,研发必须的成本使行业过度关注常见病的疗法。患者少的罕见病药品开发风险太大,很可能导致投资失败。
1983年的《孤儿药法案》 (ODA)鼓励罕见病药品,即“孤儿药”的开发。ODA颁布之前,行业关注的是如何收回药品开发的大量投资:为了最大限度地盈利,他们常寻求以优惠价格治疗最多患者的候选药品,获得可靠的投资回报。
美国国会第97次会上,主席团成员Henry Waxman促成了ODA的通过,包括为药品申办方提供一系列激励措施开发药品治疗罕见病或病症。ODA授权FDA,通过孤儿药开发办公室(OOPD),将影响不到20万名美国人,或用于超过20万患者疾病,但申办方无任何合理期望收回其研发费用的药品,定义为“孤儿药”。
一旦药物获得孤儿药资格认定,申办者则有权享受ODA规定的多项福利。如提供相当于研发费用25%的税收抵免;此外,它还为临床研究药物提供补贴和拨款来降低研发成本。最重要的是,若该产品已获FDA批准,ODA也会为该药后续罕见病适应证提供7年的市场独占期。在此期间,FDA不会批准或授予任何一个仿制药或生物类似药用于相同的适应证。此外,根据《处方药使用者付费法案》(PDUFA),申办方递交申请需缴纳一定的用户使用费,这一费用FDA也豁免了。要注意,根据《食品、药品和化妆品法》(FD&C) 和《公共卫生服务法》(PHS),ODA并未放松对小分子药品安全性和有效性的要求或生物制品安全性、纯度和效价的要求。
1983年之前,FDA只批准了38个孤儿药。到2002年,超过230个孤儿药获批;到2014年,适应症数量达到468个,涵盖373种药品;到2019年底,564种不同药物的孤儿药适应症达到838个。ODA不仅已经证明是成功的,而且 还促进了其他国家类似的立法。1993年,日本采取了类似的措施,赋予孤儿药10年的监管独占期;1997年,澳大利亚效仿了5年的独占期的做法;欧盟将ODA视为其2000年法规监管工作的样板。与日本一样,欧盟给予孤儿药10年的独占期。由此可见,美国在这一方面起到了带头作用。其他药品严格监管的市场也纷纷紧随其后,现在,那些世代得罕见病的患者们有了希望,他们的疾病在众多寻求治愈和治疗的疾病中并没有被遗忘。
《Hatch-Waxman法案》引领现代仿制药行业发展
对美国罕见病患者而言,另一个成功则来自1984年的《药品价格竞争和专利期恢复法》,通常称为《Hatch-Waxman法案》。《Hatch-Waxman法案》对FD&C法案进行了修订,通过提交简化新药申请(ANDA)创新出药品批准的简化途径。
此前,ANDA只是适用于1962年之前批准的药物的政策。而《Hatch-Waxman法案》为仿制药申办方提供了一条新路,即通过编写ANDA申请,减少不必要的和不符合伦理的人体临床试验的需要,生产和参比制剂(RLD)在化学上相同(或药学等效)和临床上等效(或生物等效)的副本。《Hatch-Waxman法案》为原研药申办方提供了新化学单体(NCE)从批准之日起5年的独占期。期间,FDA会暂停批准任何ANDA。
《Hatch-Waxman法案》进一步要求仿制药公司提交他们的小分子药物是如何与参比制剂的专利相关。参比制剂的专利由申办方提交,列于橙皮书中,橙皮书是新药申请(NDA)和相关数据的存储数据库。而第一个上市的仿制药有时会享有180天的独占期,在此期间,FDA不会批准其他仿制药。FDA的研究表明,后续的市场进入者使这一领域的竞争迅速升温。推动处方药成本下降——据统计,当同一原研有6个或更多竞品时,降价高达95%。
《平价医疗法案》通过BPCIA创建了生物类似药途径
《Hatch-Waxman法案》为医疗立法的另一个里程碑——生物类似药的出现奠定了基础。生物制品本质上比小分子化学药物更复杂。虽然受《公共健康服务法》管辖,但同样需要符合FD&C法案对药品安全性和有效性的要求。到2007年为止,美国人在处方药上共花费2865亿美元。其中14%,即403亿美元花在生物制品上。2010年的《平价医疗法案》(ACA) 第VII篇和《生物制品价格竞争与创新法案》(BPCIA),设置了一个针对生物制品的简化路径即生物类似药。它与参比制剂有生物相似性或临床等效性。BPCIA旨在与《 Hatch-Waxman法案》一样鼓励仿制药生产商之间的竞争相同的方式来提高生物制品的可负担性,生物类似药需证明自己与FDA已批准的参比生物制剂“生物类似”或“可互换”。
BPCIA要求生物类似药申办方通过收集并提交至少一项人体研究的临床前和临床数据,证明生物类似药与参比制剂在安全性、纯度和效价方面不存在有临床意义的差异。FDA可酌情决定是否豁免这些研究。此外,FDA还要求生物类似药申办方在申请中阐明该药与参比制剂在作用机制、适用条件、给药途径、剂量、规格均一致,并且是在能确保安全性、纯度和效价的工厂生产出来的。
本着与《Hatch-Waxman法案》对新化学实体独占期设定相同的精神,BPCIA也为参比生物制剂申办方提供了12年的独占期,同理,在此期间FDA不会批准其他生物类似药的申请。值得注意的是,BPCIA设立了生物类似药申办方可在获得参比制剂申办方许可的情况下进行专利信息交流的机制以及产品的跨州销售可能会侵犯参比制剂申办方的知识产权(IP)——所谓的“专利舞蹈”的解决方法。随着知识产权成为生物类似药上市和成功商业化的关键拐点,虽然申办方可自行选择生物类似药申请人,但这种规定为今后罕见病和流行病药物开发提供了诉讼的途径。同样的趋势在仿制药领域已开始初见端倪。小分子药物申办方开始不断对其活性部分提交后续专利,进一步击退仿制药竞品进入。
知识产权
经《Leahy-Smith美国发明法》(AIA,2011)修订的美国宪法和美国法典第35篇规定,专利发明人自备案之日20年内有权排除他人使用发明人的新的和有用的、新颖的、非显而易见性的发明,一项为期20年的专利担保,自批准之日起生效。这与上文讨论的监管独占期有着根本性的不同。专利持有人独占权是属于发明人的权利——即最终是属于参比制剂的申办方——监管独占权明确约束了FDA在独占期到期之前,不得批准仿制药或生物类似药(或其适应症)的申请,禁止他人生产或使用其发明,或将其商业化。这些术语在实践中相互平行,一个的到期与另一个的到期无关。
为仿制药申办方明确规划了路径:仿制药申办方查阅橙皮书了解其活性部分和相关联的NDA,明确监管独占期和参比制剂申办方为保护其产品的不得由他人使用和销售而申请的专利失效期。仿制药申办方必须等待监管独占权到期后才能获得FDA的批准。但对于专利,仿制药申办方要么耐心等待专利过期再上市,或宣布专利无效且不可强制执行,要么不侵犯原研的专利——必要时需做好充分准备向法院起诉(专利挑战)。
另一方面,生物制剂不同于小分子产品,是结构复杂的大分子产品。依据2020年12月21日颁布的《2021年统一拨款法案》,生物类似药申办方需参考《紫皮书》这个可检索已获批生物制剂和已获批生物类似药数据库。该数据库提供的信息很少,仅限于参比制剂的标签、批准日期、首次许可日期、生物制品许可申请(BLA)编号、申请人(申办方)名称,以及产品版本。至于独占权何时到期,及更重要的专利何时到期,甚至参比制剂申办方在任何推定的诉讼中对生物类似药申办方可主张哪些专利,均没有提供任何信息。今后随着《紫皮书连续性法案2020》通过,我们将随时可查阅生物制剂专利的额外信息,该法案将要求FDA在《紫皮书》中编写生物制品的所有监管独占权,并依据PHS法案第351(l)条专利舞蹈的程序披露的生物制品专利,公布其专利期。该法律由FDA实施,但存在以下问题,如时间轴,递交过程是什么,通过专利舞蹈披露的专利是否能为公众提供某一既定产品的知识产权全貌等。尽管如此,这依然是朝着提高生物制剂领域透明度迈出的重要立法步骤。
研究目的
美国国会为罕见病患者做了很多工作。ODA援助激励了罕见病领域的创新,推动了科学和医学的进步,并为数以百万计的美国人带来了希望,否则这些人可能得不到安全有效的治疗。通过Hatch-Waxman法案和BPCIA,美国国会借助市场调节机制促进品牌药和生物制品的治疗等效替代品的商业化——竞争促使成本降低并激发创新。二者都在为患者提供“买得起”和“买得到”的药物上取得了巨大成功。因为更多的人能够买到负担得起的药物和生物制品来治疗或管理疾病,同时也助益罕见病患者。美国罕见病协会(NORD®)委托Avalere汇总关于孤儿药法案当前影响的数据以及它以孤儿药独占权(ODE)的形式提供的市场保护的作用及相关专利保护的影响。Avalere是一家领先的医疗保健咨询公司,专门从事生命科学、健康计划和医疗服务提供机构的策略、政策和数据分析。
本报告还统计了与孤儿药相关的生物类似药和仿制药数据,全面评估了FDA的孤儿药数据库、Drugs@FDA、橙皮书、紫皮书以及公开的专利信息。报告总结了所有获得孤儿药资格认定的药品和生物制剂、其罕见病适应症和独占权、与参比制剂相关的所有有效专利以及参比生物制品的知识产权保护情况。
研究结果分孤儿药和仿制药/生物类似药已达成的及尚达成的目标。
数据和讨论
孤儿药适应症
截至2020年7月8日,共有599种药物和生物制品,至少获得一个孤儿药认定资格,目前或已经在某个时间点获得FDA批准;出于安全性,疗效或商业问题,其中有47种已经停药。在这599种药物中,413个有小分子药物相关的NDA,186种是有BLA的生物制品。市面上的这552种中有394种享有某种形式的专利或孤儿药独占权保护。在截至2020年12月1日未获得保护的其余158种产品中,已有仿制药上市的有81种。这并不是说享有专利或监管独占权保护的产品自身不会有仿制药,而是说有些产品有后续的孤儿药适应症的话,那么它的仿制药的标签中适应证内容必须与原研的内容“剥离”以符合Hatch-Waxman或BPCIA的要求,即如果参比制剂或参比生物制品某个(些)特定适应症仍受到某种形式的独占权保护,则仿制药或生物类似药标签上所列的适应证数目必须比FDA批准的原研标签少。换句话说,仿制药可以上市这么长时间因为它的标签不包括或“剥离”受保护的罕见病适应证,业内称之为“缩减标签”——依监管事项要求,针对特定疾病或患者,该仿制药或生物类似药需明确列出不适用之情况的标签。
当参比制剂或参比生物制品专属的独占权到期后,仿制药或生物类似药申办方可扩充其标签,纳入不再受保护的适应症。同样,专利保护本身也并不能阻止仿制药上市。因为仿制药或生物类似药生产商可能与原研公司达成一种授权许可开发和销售仿制药。但一般会在专利期满前给原研公司提供专利许可的契约对价。
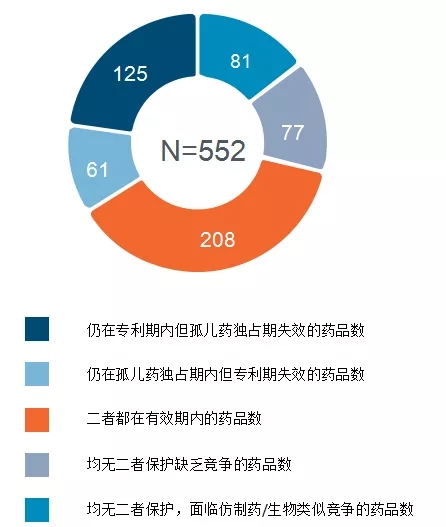
图1.孤儿药资格认定药物的专利和孤儿药独占权情况
在那些出于安全性或疗效原因未停用的产品中,有186个活性单体(分别为179种药品和7种生物制品)的仿制药或生物类似药已获批上市。事实证明, 552种药品中绝大多数获得孤儿药资格认定后至少有一种适应证获得了FDA的批准。很多产品有多个适应症,但只有约10%的产品有三个或三个以上。
事实证明,552种药品中绝大多数获得孤儿药资格认定后至少有一种适应证获得了FDA的批准,其中有37个产品(27种药物和10种生物制剂)最初获批的是非罕见病适应证,后来补充了一种罕见病适应证。换句话说,在药品初上市时FDA批准的标签内容包括但不限于一种罕见病适应证。那37个最初未获得罕见病资格认定的药物是上市后做罕见病适应证的临床试验,再提交新药补充申请或或BLA(即sNDA或sBLA),扩充其标签内容而获得的。
此外,154种产品(104种药品和50种生物制品)获批为孤儿药,后续获得至少一个罕见病适应症。这通常比较合理也符合预期。因为随着申办方和临床医生对药物了解深入,他们可能会发现这种罕见病最初未进行研究或初上市时缺乏实质性证据。对于罕见病患者来说,这也是一个利好消息——申办方在常见病现有药物安全性数据非常明确的基础上进行标签扩充,获得罕见病适应证的批准所需额外的数据相对较少。
孤儿药数据库的分析中可看到了这一点(见表1):
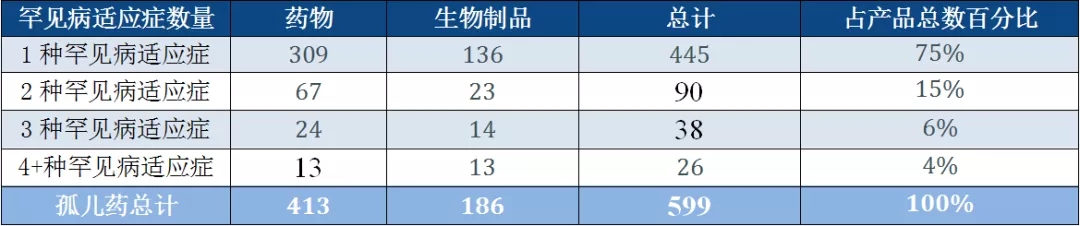
多数药品适用于多种罕见病适应症,仅有10%用于3种以上
仿制药和生物类似药具有混合输出(见表2):
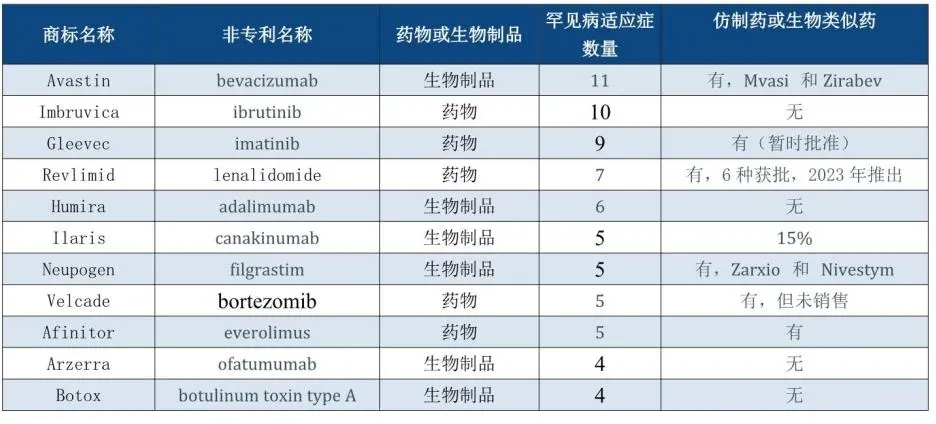
随着参比制剂获得新的罕见病适应症,只要孤儿药独占权还适用于该参比制剂品,这实际上说明仿制药和生物类似药申办方在这些标签所列的适应症的市场准入上要晚七年,标签上所列适应症还比参比制剂的少(也就是说药房必须同时备货参比制剂和仿制药或生物类似药以满足不同患者的需求)。这就影响了患者获得药品,符合ODA的精神——原研的申办方应该享受这种垄断带来的获益,因为他们的产品可以治疗一类新的患者,产品独占权基本上(化学药品为5年/生物制剂为12年)不会因为额外的罕见病适应症而变化——当然,这必须限于该适应症
关于专利和知识产权保护
迄今为止,美国仅批准了29种生物类似药,其中仅四分之一用于罕见病。表3总结了受多年专利保护的产品,主要是化学药品。
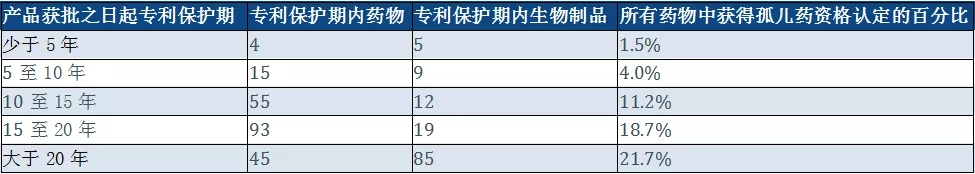
表3:许多孤儿药产品具有远过监管独占期或高达20年的既定专利保护
值得注意的是,超过五分之一的产品有超过20年的预期或预估的专利保护期。
结 论
近年来,科技发展为罕见病患者带来了巨大希望。在美国,某些病种已获得或将获得一种或多种安全的有效治疗。但仍有很多工作要做。仍有7000多种罕见病,其中超过90%没有FDA批准的疗法。今天对ODA的需求与1983年一样强烈。ODA的总体成功已成为医疗付费者和医疗服务提供机构必须考虑的一个问题,因为这涉及到这些可用罕见病疗法的净成本。
Hatch-Waxman法案和BPCIA将竞争引入强大的仿制药和新兴生物类似药行业,降低药品和生物制品的医疗支出,提供可负担但同样安全有效的替代品,提高所有药品(包括孤儿药)的可及性。专利法赋予发明人排除他人利用其发明的权利,激励创新以“促进科学和实用艺术的进步”。监管独占权和知识产权保护对发明者和生命科学创新公司在将药物推向市场上所投入的大量时间、精力和资本(估计10亿美元)上的激励至关重要。这有可能推动罕见病领域的创新和孤儿药的获得;对于只能接受医生的超说明书用药的,或者更糟糕的是,无药可用的罕见病患者而言。创新会带来新的治疗和治愈方法;同样重要的是,只要美国国会在合理的时间内为竞争扫清障碍,就可以很容易地通过稳健的仿制药/生物类似药市场来实现孤儿药的最优准入。
本文翻译自美国罕见病协会发表的报告:ORPHAN DRUGS IN THE UNITED STATES: An Examination of Patents and Orphan Drug Exclusivity
译:Katherine 黄娟