2024年5月20日,国家药监局药审中心发布《中国新药注册临床试验进展年度报告 (2023年)》。
报告指出,罕见疾病药物临床试验数量呈现显著增长趋势(119项 vs. 68 项),较 2022 年增加了 42.9%,且适应症领域进一步扩大,包括抗肿瘤药物、血液系统疾病、神经系统疾病、呼吸系统疾病及抗过敏药物和风湿性疾病及免疫药物。
以罕见疾病中文名称为关键字对罕见病药物临床试验进行分析。从临床试验数量上看,呈逐年递增趋势,2023 年共登记 119 项,较 2022 年增加了 42.9%(68 项)。按药物类型分析,治疗罕见疾病的药物主要为化学药品和生物制品,分别登记了 56 项和 63 项。按适应症分析,主要以抗肿瘤药物、血液系统疾病、神经系统疾病、呼吸系统疾病及抗过敏药物和风湿性疾病及免疫药物为主,占年度罕见病临床试验总量的 75.6%,其中抗肿瘤药物临床试验数量明显增加,达25 项,占年度罕见病临床试验总量的 21.0%。
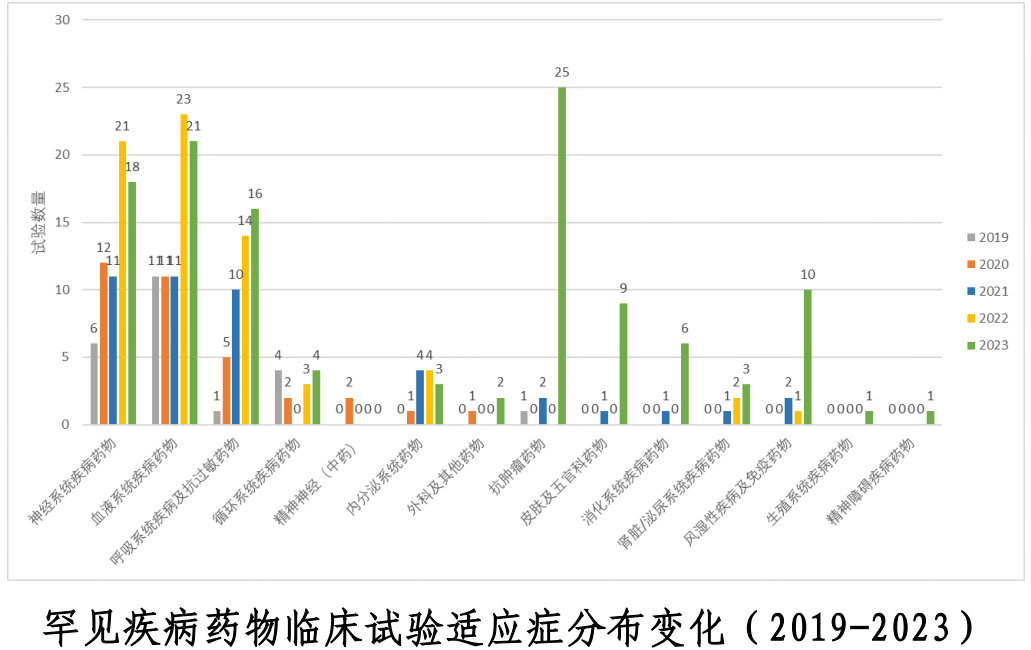
数据说明:罕见疾病参考国家卫生健康委员会等部门分别于 2018 年5 月和 2023 年 9 月联合制定发布的《第一批罕见病目录》和《第二批罕见病目录》