罕见病的政策法规,一直以来是社会各界与罕见病人士都十分关注的领域。不同罕见病政策的推动,能带来整个罕见病研发甚至市场的变动,可以说是许多罕见病患者的福音。因此本次作者言蹊以时间轴为列表,详细的列举了国内外相关的罕见病政策法规信息,供大家参考。
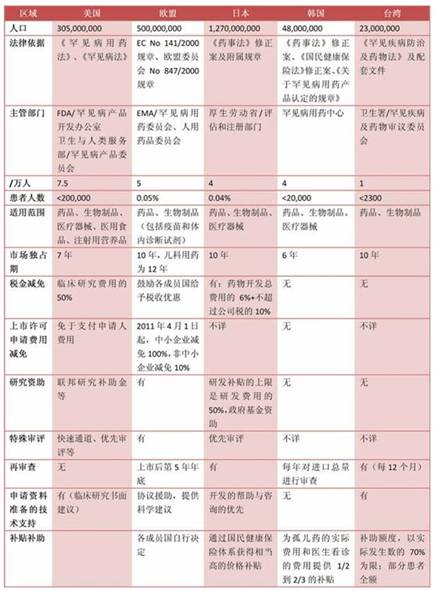
国外的罕见病政策法规
国内罕见病药物政策法规大事纪:
中国最早的有关罕见病的医学法规是在1999年出版的《药品注册管理办法》,其中提到罕见病和治疗罕见病新药,但并未对“罕见病”的概念进行明确界定。
2007年新版《药品注册管理办法》中对罕见病临床试验和审批有两条优惠措施,但依然未给出罕见病的具体定义或范围,这给罕见病相关研究和诊疗设置了第一个最为基础的障碍。
2011年,《医学科技发展“十二五”规划》针对各科疾病以及罕见病,要突出临床医学特点,提高诊疗水平;
2012年,《国家药品安全“十二五”规划》鼓励罕见病用药的研发;早在2012年,国务院印发的《国家药品安全“十二五”规划》就已开始鼓励罕见病用药的研发。
2013年2月,国家食药监总局在《关于深化药品审评审批改革进一步鼓励药物创新的意见》中,提到要对罕见病等特殊人群用药实行优先审评,将政策落实到了制度层面。
2014年上半年发布的《关于深化药品审评审批改革进一步鼓励药物创新的意见》将对重大疾病、罕见病、老年人和儿童疾病具有更好治疗作用的药物给予加快审评。
2015年8月国务院发布的〔2015〕44号令,正式将防治艾滋病、恶性肿瘤、重大传染病、罕见病等疾病的创新药的审评审批列入加快审查流程。11月,CFDA发布《关于药品注册审评审批若干政策的公告》又将上述类别药物的申请执行单独排队、加快审评审批。11月13日,CFDA最新公告,罕见病用药首次列入加快临床药品审批名单.
2016年12月7日,总局公布第十二批优先审评名单,多个血友病用药名列其中
2016年5月12日,国务院办公厅印发了《深化医药卫生体制改革2016年重点工作任务》,在第四部分(健全药品供应保障机制)中又强调到“强化短缺药品供应保障和预警,建立多部门会商联动机制,以省(区、市)为单位选择若干医院和基层医疗卫生机构作为短缺药品监测点,完善短缺药品信息报送制度……深化药品医疗器械审评审批制度改革。进一步畅通儿童、老年人等特殊人群用药以及罕见病用药、临床急需药品的审评审批专门通道,加快注册审评进度。”
2017年2月9日,国务院办公厅印发《关于进一步改革完善药品生产流通使用政策的若干意见》。《意见》中强调到要借鉴国际先进经验,探索按罕见病、儿童、老年人、急(抢)救用药及中医药(经典方)等分类审评审批,保障儿童、老年人等人群和重大疾病防治用药需求。
2017年5月11日国家药监局,发布了一项关于鼓励罕见病药物和器械研发的新规,称由卫生计生部门公布罕见病目录,建立罕见病患者注册登记制度。
2017年11月,CFDA发布了《首批专利权到期、终止、无效尚且无仿制申请的药品清单》,对于该通知的目的,文件表示是为了引导仿制药研发生产,提高公众用药可及性。评审中心对国内化合物专利权到期、终止、无效且尚无仿制申请的国外已上市药品进行筛选,初步筛选出他伐硼罗等10个具有明确临床价值的药品,列入指导名单。此次发布的目录,主要集中在罕见病用药领域,正是对“可及性”的深刻表现,也体现出药审中心对罕见病用药发展的重视。
2017年10月,CDE发布了《接受境外临床试验数据的技术要求》:对于用于危重疾病、罕见病、儿科用药且缺乏有效治疗手段的药品注册申请,经评估其境外临床试验数据属于“部分接受”情形的,可采用有条件接受临床试验数据方式,在药品上市后收集进一步的有效性和安全性数据用于评价。
2017年10月,中共中央办公厅、国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,提出了36条具体改革措施,其中包括罕见病治疗药品医疗器械一系列鼓励政策,如可附带条件批准上市等。此次出台的《意见》特别提到:“罕见病治疗药品医疗器械注册申请人可提出减免临床试验的申请。对境外已批准上市的罕见病治疗药品医疗器械,可附带条件批准上市,企业应制定风险管控计划,按要求开展研究。”