导语
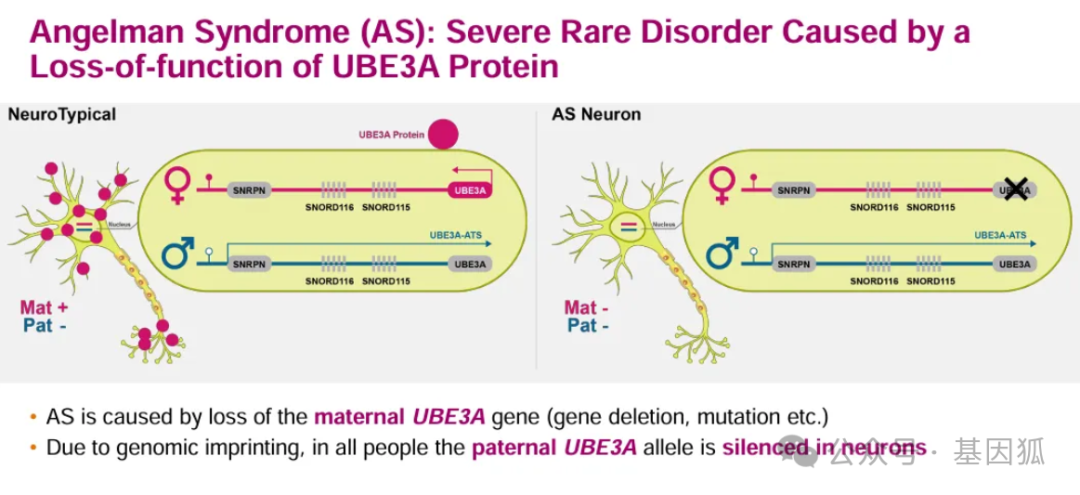
天使综合征(Angelman syndrome, AS) 又称快乐木偶综合征,是由母源15号染色体长臂 (15q11-q13) 区域内编码泛素蛋白连接酶E3的UBE3A基因表达异常或功能缺陷引发的神经发育障碍性疾病。天使综合征的发病率大概为1/20 000~1/12 000,其特征为严重的发育迟缓和言语障碍、步态共济失调、肢体震颤以及独特的快乐行为,已经列入我国《第一批罕见病目录》。其创新的RNA靶向反义药物ION582,已获得美国FDA突破性疗法认定.
近日,Ionis Pharmaceuticals公司今宣布,其用于治疗天使综合征的在研反义寡核苷酸 (ASO) 疗法ION582已获得美国FDA授予的突破性疗法认定 (BTD)。这一认定不仅凸显了AS患者巨大的未满足医疗需求,更预示着ION582有望为这一严重疾病带来首个疾病修饰疗法,标志着Ionis在罕见病领域的又一里程碑式进展。
|突破性疗法认定:加速罕见病新药审批
近日,Ionis Pharmaceuticals公司 (Nasdaq: IONS) 今宣布,其用于治疗天使综合征 (Angelman syndrome, AS) 的在研反义寡核苷酸 (ASO) 疗法ION582已获得美国FDA授予的突破性疗法认定 (Breakthrough Therapy Designation , BTD)。这一里程碑进展再次证明了Ionis在利用RNA技术解决复杂神经系统疾病方面的创新实力,有望为全球数万名天使综合征患者带来全新的疾病修饰疗法。
此前,ION582已获得美国FDA和欧洲药品管理局 (EMA) 的孤儿药资格认定,以及美国FDA的快速通道认定和罕见儿科疾病认定,多重加速通道的加持,无疑将进一步加快其上市进程。
天使综合征的核心病理在于位于15q11-q13染色体区域的母源UBE3A基因功能丧失,该基因编码的UBE3A泛素连接酶在神经元发育和功能中扮演关键角色。研究表明,不同基因缺陷类型的临床表现也有很大的差异。当母源UBE3A基因缺失或突变时,由于父源UBE3A基因通常被印记沉默,导致UBE3A蛋白表达不足,从而引发一系列严重症状,包括严重的智力障碍、共济失调、癫痫发作以及严重的语言障碍。目前,临床上主要通过对症支持治疗管理癫痫和睡眠障碍等,但缺乏针对病因的疾病修饰疗法。
反义寡核苷酸 (antisense oligo‐nucleotides, ASOs) 是调节靶向mRNA表达的重要分子工具,它可以与靶mRNA结合,通过核糖核酸内切酶(Rnase H) 介导其降解。ION582的设计理念正是基于对UBE3A基因调控的深入理解,旨在特异性抑制UBE3A反义转录本 (UBE3A-ATS) 的表达。UBE3A-ATS是一种长链非编码的RNA反义转录物,通过干扰UBE3A转录本在父源等位基因的延伸,阻断了父源等位基因的UBE3A表达。ION582预期能够“去抑制”父源UBE3A基因,从而上调UBE3A蛋白的产生,恢复其在神经系统中的正常功能,从根本上纠正天使综合征的病理学基础。
ION582的突破性疗法认定得益于其I/II期HALOS研究 (NCT04423590) 的积极数据。该研究评估了ION582在AS患者中的安全性、耐受性、药代动力学和初步疗效。结果显示,ION582不仅耐受性良好,而且在多个关键功能领域展现出令人鼓舞的临床改善,包括:
沟通能力: 患者在非语言沟通、眼神交流和理解指令方面有所改善。
认知功能: 观察到患者在学习新技能和解决问题能力上的进步。
运动功能: 患者的平衡、协调和精细运动技能有所提升,这对于改善其日常生活自理能力至关重要。
这些持续且一致的改善提示ION582有潜力成为首个能够从多个维度改善天使综合征患者核心症状的疾病修饰疗法。
目前,一项全球多中心、随机、双盲、安慰剂对照的III期REVEAL研究(NCT06914609) 已启动,旨在进一步确认ION582在更大规模天使综合征患者群体中的疗效和安全性,预计将于2026年完成患者招募。这一关键性临床研究的顺利推进,将为ION582的最终获批上市提供坚实的数据支持。
Ionis Pharmaceuticals公司成立于1989年,是一家专注于RNA靶向治疗的生物制药企业,总部位于美国加利福尼亚州卡尔斯巴德。经过30多年的发展,Ionis已经成长为反义寡核苷酸 (ASO) 治疗领域的开拓者和领导者,通过其创新的反义DNA技术设计药物,调节特定蛋白质的产生,直接解决神经和心脏代谢疾病的病因。
作为RNA靶向药物领域的先驱,Ionis公司的研发管线涉及心脏、代谢、神经、传染病、眼科、血液病等多个治疗领域。公司通过其反义技术平台,针对疾病的根本原因开发变革性治疗方法,特别是在罕见疾病领域取得了显著进展。
此前,Ionis已成功开发出SPINRAZA® (脊髓性肌萎缩症)、WAINUA® (遗传性转甲状腺素蛋白介导淀粉样变性多发性神经病) 和QALSODY® (SOD1-ALS) 等重磅药物,展示了其在RNA技术平台上的强大实力和丰富的临床转化经验。此次ION582获得FDA突破性疗法认定,是其在罕见神经系统疾病领域深耕的又一重要成果。
在当前“孤儿药”研发日益受到重视的背景下,ION582的临床数据和监管状态,彰显了其作为潜在首创 (first-in-class) 疾病修饰疗法的巨大价值,也有望在不久的将来真正惠及全球的天使综合征患者。