2025年7月7日,KalVista Pharmaceuticals 宣布美国食品和药物管理局(FDA) 已批准EKTERLY®(sebetralstat)一种新型血浆激肽释放酶抑制剂,用于治疗12岁及以上成人和儿童患者的遗传性血管性水肿(HAE)急性发作。该药物是唯一一个口服按需治疗HAE的药物。
遗传性血管性水肿(HAE)是一种罕见遗传病,因C1酯酶抑制剂(C1INH)缺乏或功能障碍,导致激肽释放酶-激肽系统失控激活,患者会出现身体各部位痛苦且可能危及生命的组织肿胀发作。治疗指南建议尽早治疗所有发作,以阻止肿胀进展、缩短消退时间,无论发作的解剖位置或严重程度如何。

EKTERLY®(sebetralstat)是一种新型血浆激肽释放酶抑制剂,是美国获批的首个且唯一口服按需疗法,用于治疗12岁及以上人群的遗传性血管性水肿(HAE)急性发作。目前研究正探索其在2至11岁儿童中的使用,全球主要市场的多项监管应用也在审查中,有望成为全球HAE管理的基础疗法。

其有效性和安全性基于KalVista的3期KONFIDENT临床试验:该试验随机分配了来自20个国家/地区66个临床地点的136名HAE患者,数据于2024年5月发表在《新英格兰医学杂志》上,显示与安慰剂相比,EKTERLY能显著更快缓解症状、减轻发作严重程度并加速发作消退,且耐受性良好,安全性与安慰剂相似。
此外,正在进行的开放标签扩展试验KONFIDENT-S进一步支持其效果:截至2024年9月,数据显示EKTERLY能使患者在发病后中位10分钟内治疗发作;在涉及喉部、腹部的发作中,症状缓解的中位时间为1.3小时;且在超过1700次发作中,600mg剂量的EKTERLY安全性特征与KONFIDENT试验中观察到的一致。
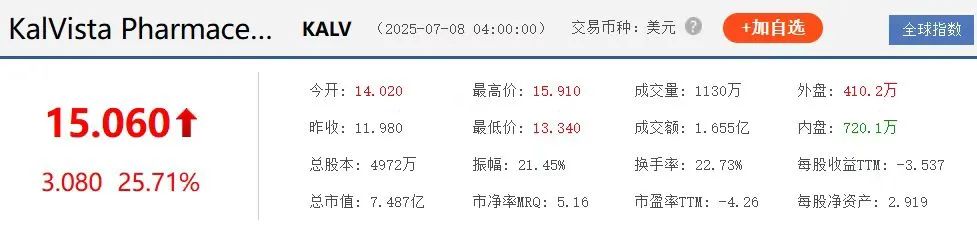
之前,全球获批用于治疗HAE的药物均为静脉注射或皮下注射制剂,如赛诺菲的达那唑、CSL的Berinert、武田的艾替班特等,但这些药物均为静脉注射或皮下注射制剂。Sebetralstat的获批,标志着HAE按需治疗进入“口服时代”。受此消息影响,KalVista股价盘后大涨25.71%。
EKTERLY®(sebetralstat)的定价是多少?
EKTERLY®(sebetralstat)的具体定价未明确,仅知其定价与其他按需治疗药物处于相同区间,且有分析师推测其定价可能略高于每支售价1.1万美元的Firazyr。