今日,欧盟委员会(EC)宣布授予辉瑞(Pfizer)所开发的一次性基因疗法Durveqtix(fidanacogene elaparvovec)有条件上市许可,用于治疗重度和中重度血友病B成人患者,这些患者体内无凝血因子IX(FIX)抑制剂,且没有检测到针对腺相关病毒血清型Rh74变异体(AAVRh74var)的抗体。

血友病B是一种危及生命的退行性疾病,患者由于基因出现突变,导致缺乏凝血因子IX。患有该疾病的患者容易发生关节、肌肉和内脏器官出血,出现疼痛、肿胀和关节损伤。目前的治疗包括终生每周或每月多次定期静脉输注凝血因子IX,一年可能需要进行超过一百次以上的治疗,以暂时替代或补充低水平的凝血因子。
这次欧盟批准Durveqtix主要是基于单组、开放标签临床3期试验BENEGENE-2的结果,该研究旨在评估Durveqtix治疗中重度至重度血友病B(定义为凝血因子IX循环活性≤2%)成年男性受试者(18-65岁)的疗效和安全性,此试验共有45名患者入组。
分析显示,BENEGENE-2试验达到其主要终点,即与FIX预防性治疗方案相较,Durveqtix显著降低了出血频率。Durveqtix组患者的年化出血率(ABR)为1.44,接受预防性疗法患者的ABR为4.50(p=0.0084),减少幅度达68%。。此外,60%的Durveqtix组患者在个体观察期间(范围:2-4年)保持无出血事件,此数值在导入期接受常规预防治疗的患者中仅为29%。患者在接受Durveqtix治疗后,使得预防性凝血因子IX的消耗量降低了92.4%。
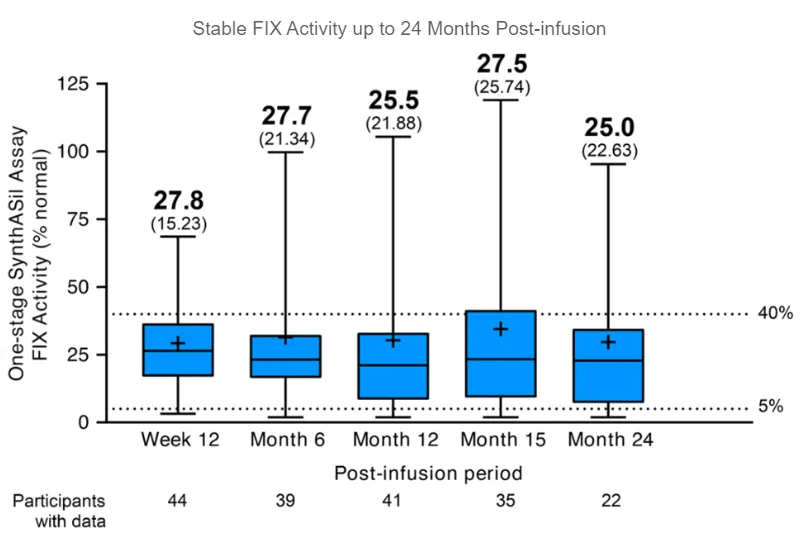
▲在试验中,患者接受Durveqtix输注后,体内FIX活性稳定维持(图片来源:参考资料[4])
Durveqtix总体耐受性良好,安全性结果与之前的1/2期试验一致。研究中报告的最常见不良反应(发生率≥5%)是肝脏转氨酶升高,但可通过皮质激素治疗。未报告血栓事件、与治疗或与输液相关的严重不良事件,亦没有观察到患者出现FIX抑制剂。接受Durveqtix治疗的患者将接受15年的随访,包括在关键临床试验中的6年和作为另外一项研究一部分的额外9年,以监测该基因疗法的长期疗效和安全性。
Durveqtix是一种新型的基因疗法,含有生物工程化的腺相关病毒衣壳和编码高活性FIX变体的转基因。对于血友病B患者来说,这种基因治疗的目标是使他们能通过一次性治疗产生自体的FIX蛋白,而非像目前的标准治疗那样需要定期静脉输注FIX。辉瑞于2014年12月以2000万美元预付款从Spark Therapeutics获得该疗法。加拿大卫生部(Health Canada)于今年1月批准该疗法上市,美国FDA则在今年4月批准此基因疗法,商品名为Beqvez。
除了Durveqtix,辉瑞目前还有基因疗法giroctocogene fitelparvovec处于临床3期试验阶段。该公司日前公布giroctocogene fitelparvovec在用于治疗中度至重度血友病A成人患者的3期试验AFFINE当中达到主要终点与关键次要终点,患者在接受单次剂量输注后,显示出与输注前相比平均总ABR显著降低(1.24 vs 4.73;单侧p值=0.0040)。此外,治疗后的平均需要治疗ABR也显示出统计学上显著的下降,从输注前的4.08下降至输注后的0.07,降幅达98.3%(单侧p值<0.0001)。此外,辉瑞也正在进行一项3期试验,检视其在研组织因子途径抑制单抗marstacimab用于治疗体内存有(或无)凝血因子抑制物的血友病A和B患者。目前美国FDA与EMA正在审评marstacimab的上市许可申请。
目前获批上市的血友病基因疗法包含由BioMarin Pharmaceutical公司开发、在2022年8月获欧盟上市批准的Roctavian(valoctocogene roxaparvovec),这是首款治疗血友病A的获批基因疗法,该疗法随后在2023年6月获美国FDA批准。Roctavian使用AAV5病毒载体递送表达凝血因子VIII的转基因。今年6月所公布该疗法长期研究结果显示,患者在接受Roctavian输注后4年,展现长期持续的出血控制和凝血因子VIII(FVIII)表达。在第4年,试验内的110例受试者中有73.6%(81例)的出血次数为零。
而由CSL Behring公司所开发Hemgenix(etranacogene dezaparvovec)则在2022年获FDA批准成为首款治疗血友病B成人患者的基因疗法,该疗法随后在2023年2月获欧盟批准。Hemgenix使用AAV5载体递送表达凝血因子IX Padua变体的转基因,这种变体比普通凝血因子IX的活性要强5-8倍,可以在更低的表达水平完成正常凝血功能。

图片来源:123RF
目前在研血友病相关的新分子疗法包含由信念医药自主开发的BBM-H901。这是一款携带优化人FIX的基因表达盒的重组AAV基因疗法。该药以静脉给药的方式将编码人FIX的基因导入血友病B患者体内持续表达,提高并长期维持患者的凝血因子水平,用于预防患者出血。今年6月所公布的数据显示,在长期随访3.0-4.5年期间,9例受试者的FIX持续稳定高表达,未发生出血事件,ABR为0,且完全停止了外源性FIX产品的替代治疗。信念医药在新闻稿中表示,计划于今年递交BBM-H901注射液的上市申请。ASC Therapeutics的在研第二代血友病A基因疗法ASC618则在去年12月完成1/2a期临床试验的首例患者给药。ASC618利用AAV载体递送的转基因,包含一个专有的B结构域缺失密码子优化的改良嵌合凝血因子VIII基因和一个肝脏特异性启动子。临床前研究中显示,这款基因疗法可以在更低的剂量下产生治疗水平的凝血因子VIII蛋白。此外,罗氏(Roche)旗下Spark Therapeutics公司所开发的血友病A基因疗法SPK-8011的3期试验正在进行病患招募,该疗法利用AAV载体表达密码子经过优化的凝血因子VIII的转基因。
而由Be Biopharma公司开发的潜在“first-in-class”的自体B细胞疗法(BCM)BE-101也在今年6月获美国FDA批准IND申请。BE-101旨在将人类FIX基因插入原代人类B细胞,从而表达可治疗血友病B的活性FIX。在临床前研究中,单次使用BE-101已被证明能够提供具活性和持续的FIX水平。该公司计划在今年下半年启动1/2期临床试验,以评估BE-101在中重度至重度血友病B成年患者中的安全性和初步疗效。
参考资料: