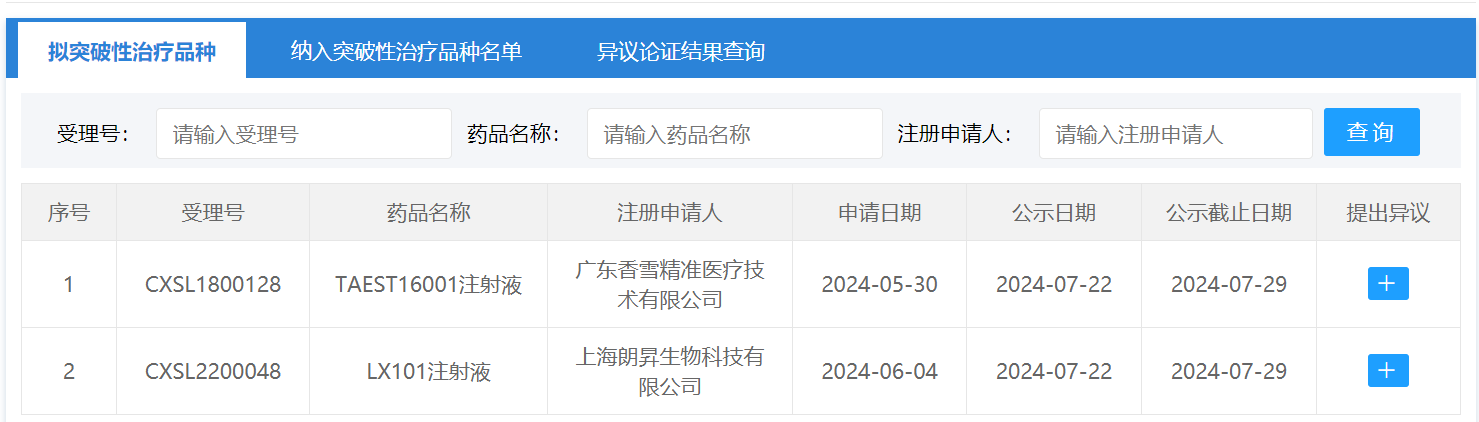
今日(7月22日),中国国家药监局药品审评中心(CDE)官网最新公示,有2款新药拟纳入突破性治疗品种。它们分别是:
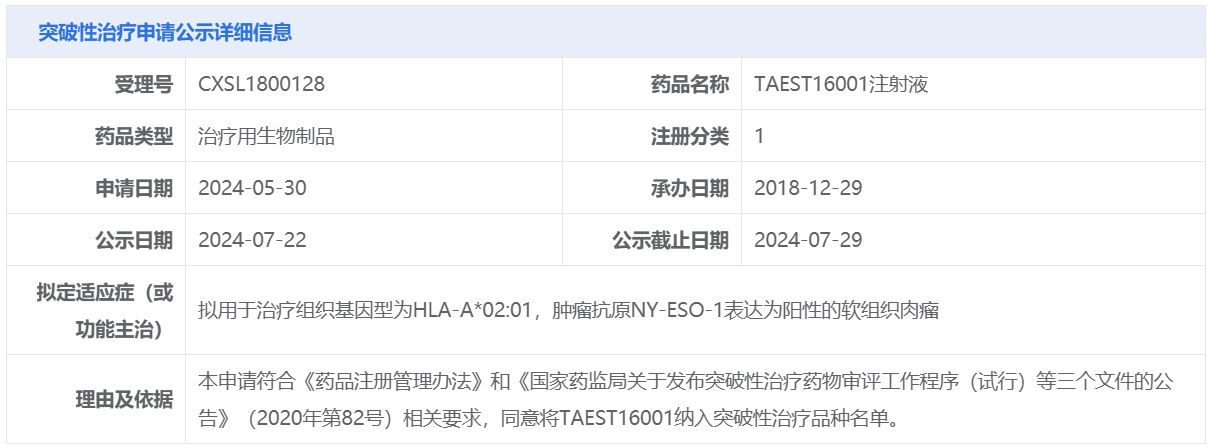
由广东香雪精准医疗技术有限公司申报的TAEST16001注射液,这是一款TCR-T细胞免疫治疗产品,拟用于治疗组织基因型为HLA-A*02:01,肿瘤抗原NY-ESO-1表达为阳性的软组织肉瘤。
由上海朗昇生物科技有限公司申报的LX101注射液,这是一款AAV基因治疗药物,适用于治疗RPE65双等位基因突变相关的遗传性视网膜营养不良(IRD)患者。
TAEST16001注射液:由香雪生命科学研发,为靶向NY-ESO-1的亲和力增强的TCR-T细胞免疫治疗产品,首个开展临床研究的适应症为HLA-A*02:01阳性且表达NY-ESO-1抗原的晚期软组织肉瘤。目前该适应症的研究已完成1期临床试验,2期临床试验正在进行中。 其治疗晚期软组织肉瘤患者的1期临床试验结果在美国临床肿瘤学会(ASCO)2022年会上进行口头汇报,并于2023年8月刊登在国际期刊Cell Reports Medicine。 初步分析时,12例患者中有5例的最佳缓解是部分缓解,客观缓解率(ORR)为41.7%
2024年,TAEST16001针对首个临床适应症晚期软组织肉瘤2期临床试验的阶段性总结数据再次入选ASCO年会。TAEST16001在2期临床早期数据显示出与之前的1期研究一致的可控的安全性和耐受性。根据RECIST1.1,由独立影像评估委员会(IRC)评估的最佳缓解率为50%(4/8)。由独立影像评估委员会和研究者评估的中位无进展生存期(mPFS)均为5.9个月。目前大多数受试者仍在随访中。
LX101注射液:LX101是朗信生物旗下上海朗昇生物科技有限公司研发的针对遗传性视网膜变性的基因治疗药物。该药物通过腺相关病毒2型(AAV2)携带正常RPE65基因,能特异识别并转染病变的视网膜色素上皮细胞,并在细胞内持续高效表达患者缺少的RPE65蛋白,恢复正常视循环,达到提升视功能的治疗目的。

朗信生物成立于2020年,致力于基因治疗创新药物研发制造,专注于眼部遗传性和慢性疾病的基因治疗领域。今年6月,朗信生物宣布完成B+轮融资。目前朗信生物共推进5个候选分子进入临床,其中LX101治疗RPE65突变相关遗传性视网膜营养不良(IRD)已进入3期临床试验。
参考资料:
[1]中国国家药监局药品审评中心(CDE)官网.Retrieved July 22,2024, From https://www.cde.org.cn/main/xxgk/listpage/da6efd086c099b7fc949121166f0130c
[2]2024 ASCO | 香雪生命科学携中国首个TCR-T细胞产品(TAEST16001)二期临床试验数据再度精彩亮相ASCO!.Retrieved Jun 02,2024, From from https://mp.weixin.qq.com/s/sbK9G6hK2Dg8LUeMxo-CCA
[3]【要闻】朗信生物LX101注射液I期临床试验完成首例患者给药. Retrieved July 28,2022, From https://mp.weixin.qq.com/s/iHWqYslzY-N9SsPdEIv8hA