近日,凌意(杭州)生物科技有限公司(以下简称“凌意生物)自主研发的LY-M003注射液获得美国食品药品监督管理局(FDA)授予的儿科罕见病药物资格(Rare Pediatric Disease Designation, RPDD)认定,用于治疗肝豆状核变性病 (Wilson’s disease,WD),又称作威尔逊病。
RPDD是针对美国患者人数少于20万且严重危及18岁以下儿童生命的儿科罕见病药物资格认定。由FDA发起的RPDD和优先券计划,是对儿科罕见病疗法的重大需求的认可,旨在鼓励这些严重或危及生命的疾病新疗法的开发。在该计划下,申办方在罕见儿科疾病新药上市申请(NDA)或生物药上市许可申请(BLA)获批后将有资格获得优先审查券(PRV)。PRV可以被用于后续任何产品上市申请时的6个月加速审评,也可以被出售给第三方。

肝豆状核变性(WD),又称威尔逊病,是一种罕见的常染色体隐性遗传代谢障碍性疾病,因位于13号染色体长臂(13q14.3)上的铜转运ATP酶β(ATP7B)基因突变导致铜转运能力障碍,从而引起铜离子在在肝脏、大脑和肾脏等多器官中积累而导致器官受累。WD临床表现复杂,主要为肝脏和神经系统的病变,包括肝功能异常、肝脏或脾脏肿大、急性肝功能衰竭、神经退行性变、神经功能障碍、选择性神经易损性和执行功能障碍等,也可出现其他系统受累表现,并可能在病程中进行性加重。
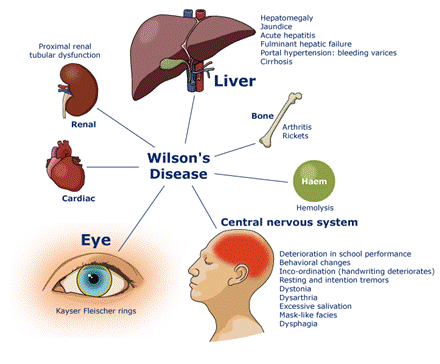
图注:肝豆状核变性病的疾病表现1
LY-M003注射液是凌意生物自主研发针对威尔逊病的AAV基因治疗药物,以重组腺相关病毒rAAV为载体,通过单次静脉输注将正常的ATP7B基因转导入患者肝细胞内,并在肝细胞中长期稳定表达正常活性的ATP7B蛋白,恢复肝细胞铜代谢能力,降低患者体内蓄积的铜离子并恢复铜蓝蛋白活性,系统性改善全身症状,从而达到治疗肝豆状核变性的目的。
凌意生物成立于2021年2月,是全球领先的单基因遗传病创新药物开发公司。公司拥有国际一流的基因疗法发现、研究开发及产业化团队,致力于FIC基因治疗管线的研发和产业化。公司立足源头创新,聚焦代谢、中枢神经系统、眼科等临床急需的疾病领域,从遗传病动物模型等关键技术入手,以最高的质量标准为患者提供一次性解决方案。
https://step1.medbullets.com/gastrointestinal/110068/wilson-disease