7 月 17 日,据赛诺菲官网显示,其与 Sobi 公司共同研发的 ALTUVIIIO(Efanesoctocog alfa)在儿童患者中进行的 XTEND-Kids III 期研究结果发表于《新英格兰医学杂志》(NEJM),展示了 ALTUVIIIO 的疗效、安全性和药代动力学特性。

截图来自:赛诺菲官网
ALTUVIIIO 是一种首创的高持续性 VIII 因子替代疗法。该药物通过独特的 Fc-VWF-XTEN 融合蛋白设计,延长了药物在体内的循环时间,从而实现每周一次给药。
XTEND-Kids 研究纳入了 74 名接受过治疗的 12 岁以下重度 A 型血友病患者。患者每周接受一次 ALTUVIIIO(每公斤体重 50 IU)预防性治疗,持续 52 周。
研究结果显示,在治疗过程中未检测到 VIII 因子抑制物(0%,95%CI:0-5%)。在按方案治疗的 73 名患者中,年化出血率(ABR)的中位数为 0.00(IQR:0.00-1.02),估计平均 ABR 为 0.61(95%CI:0.42-0.90)。
研究进一步显示,64% 的儿童未治疗出血发作,88% 未发生自发性出血。预防关节出血对于维护关节健康至关重要。在该研究中,82% 的儿童未出现关节出血,表明 ALTUVIIIO 有望提供长期的关节健康保护。
在安全性方面,ALTUVIIIO 在儿童中表现出良好的耐受性,未有因不良事件而终止治疗的情况,也未报告严重的过敏性反应以及栓塞或血栓事件。
此外,在儿科人群中,由于血液中给药因子的清除率较高,通常需要使用标准半衰期(SHL)或延长半衰期(EHL)VIII 因子产品每周注射 2-4 次。而 ALTUVIIIO 每周一次的给药方案显著减少了患者的治疗负担,体现了其在临床应用中的显著优势。
ALTUVIIIO 是首个获得 FDA 突破性疗法认定、快速通道认定和孤儿药认定的 VIII 因子疗法。欧盟委员会(EC)也在 2019 年 6 月授予其孤儿药认定。
目前,ALTUVIIIO 已在美国和日本获批上市。今年 6 月 17 日,EC 批准该药物用于成人和儿童 A 型血友病患者的常规预防性治疗和按需治疗以控制出血事件,以及围手术期管理。
在我国,ALTUVIIIO 于 2020 年 11 月进入 III 期临床研究,并且预计在 2027 年 1 月完成试验。期待未来的数据发布,为该治疗方案的有效性和安全性提供进一步的学术支持。
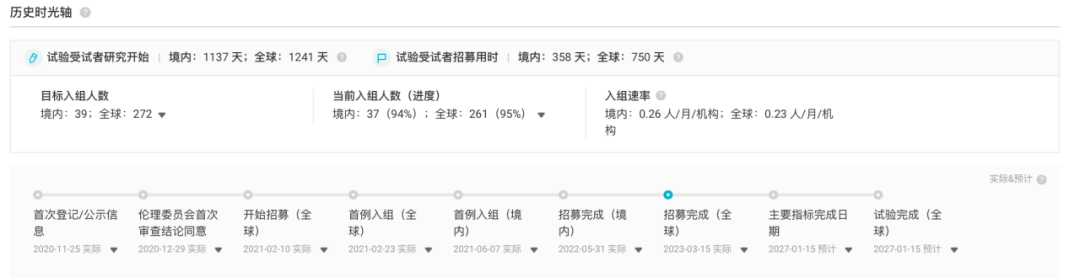
截图来自:Insight 数据库官网
对于此次研究结论,赛诺菲全球开发负责人兼首席医学官 Dietmar Berger 博士表示,XTEND-Kids 研究数据进一步证实了高持续性因子活性水平与改善健康结局,特别是关节健康之间的显著关联。为儿童血友病患者提供有效的出血保护治疗方案,不仅可以提升他们的生活质量,也为患儿家庭在日常的活动提供了更多的安心与保障。
参考内容:赛诺菲官网(https://www.sanofi.com/en/media-room/press-releases/2024/2024-07-17-21-27-40-2914957)