2023年12月8日,美国FDA宣布批准CRISPR基因编辑疗法Casgevy上市,用于治疗12岁及以上患有复发性血管闭塞危象的镰刀型细胞贫血病(SCD)患者,这是FDA批准的首款CRISPR基因编辑疗法。

镰刀状细胞贫血病是一种由遗传突变引起的疾病,患者的血红蛋白变得容易连接在一起,这会将红细胞从正常的柔性圆形转变成缺乏柔性的月牙形,犹如镰刀状。这些畸形细胞会堵塞血管,导致血管闭塞、损伤血管壁,造成威胁生命的血栓。
早在11月16日,Vertex Pharmaceuticals和CRISPR Therapeutics共同宣布,Exagamglogene Autotemcel(Exa-cel)获英国药品监管机构MHRA有条件批准上市,用于治疗镰状细胞病(SCD)和输血依赖性β-地中海贫血(TDT)。Exa-cel更名为Casgevy™。
据悉,CASGEVY™是全球首款获批上市的CRISPR基因编辑药物。
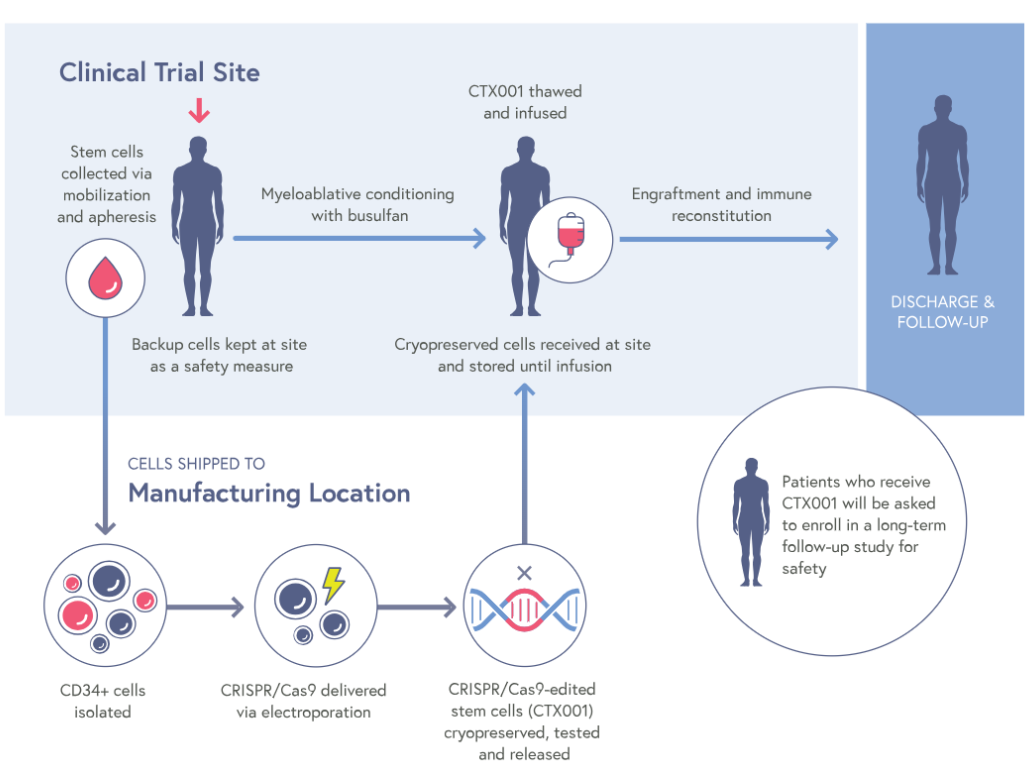
exa-cel,原名CTX001™,是一种研究性、自体、体外CRISPR/Cas9基因编辑疗法,通过编辑患者自身的造血干细胞,使得患者血红细胞可以产生高水平的胎儿血红蛋白(HbF),以治疗输血依赖性β-地中海贫血(TDT)和镰状细胞病(SCD)。
2015年,CRISPR和Vertex达成战略合作,专注于利用CRISPR/Cas9发现和开发针对人类疾病潜在遗传原因的潜在新治疗方法。exa-cel是该联合研究项目中第一个潜在治疗方法。根据协议,Vertex负责exa-cel的全球开发、制造和商业化,并与CRISPR在全球范围内以60/40的比例分割项目成本和利润。
Casgevy™在英国还没有定价,此前分析师预计Casgevy™上市后销售额为13亿美元,最高销售额或可达16亿美元(剔除风险因素)。
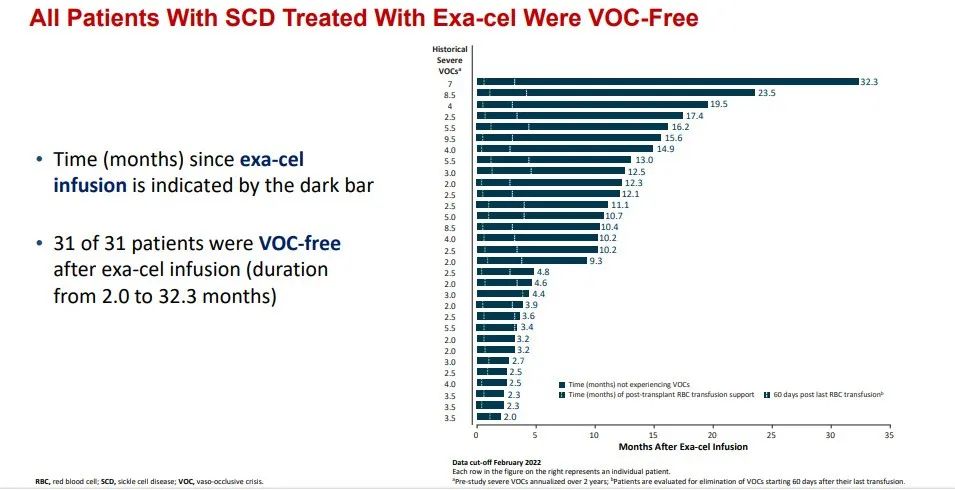
研究团队可以在患者体内检测到高水平的胎儿血红蛋白,同时患者的血管闭塞性疼痛消失了,也不再需要接受输血治疗。可见,基因编辑疗法让他们获得新生。Casgevy治疗患复发性血管闭塞危象的镰刀型细胞贫血病的全球性临床试验中,在可评估的31例患者里,有29例(93.5%)至少连续12个月无严重血管闭塞性危象发作,显示Casgevy具有一次治疗,提供功能性治愈的潜力。
参考资料:FDA公告