2023年11月30日/医麦客新闻 eMedClub News/--近日,GSK宣布其ADC产品belantamab mafodotin(Blenrep)3期临床试验DREAMM-7计划中的中期疗效分析的积极顶线结果。

结果显示,Blenrep作为2线疗法,治疗复发或难治性多发性骨髓瘤达到了无进展生存期(PFS)的主要终点,与目前用于该病的标准治疗方案相比,相比于CD38抗体对照组,PFS和OS(总生存期)均观察到了显著改善。这也意味着该款曾经在美国退市产品有望重新上市,并且适应症范围也会更大。
末线治疗失败并且在美退市的ADC
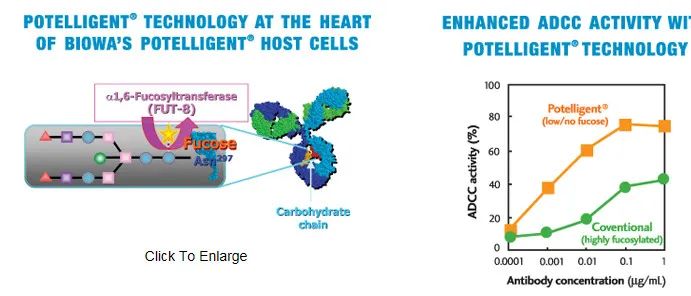
据了解,Blenrep是一款BCMA ADC,于2020年8月获得FDA加速批准上市,用于治疗先前经过四线治疗失败的多发性骨髓瘤(MM)患者。该产品的抗体采用BioWa的POTELLIGENT技术,通过去岩藻糖增强ADCC活性。
其加速上市时给予一项DREAMM-2临床的ORR、DOR数据,以及一项随机三期临床的CBR数据。DREAMM-2试验数据显示,接受最佳剂量Blenrep治疗的患者的ORR为 31%,近四分之三的缓解者的缓解持续时间超过6个月。
虽然获批上市,但该药物上市之后销量相较于其他ADC产品并不出色,2021年该产品销量1.22亿美元,2022年1.43亿美元。2022年11月7日,葛兰素史克更新了Blenrep治疗MM三期临床DREAMM-3的最新数据。
DREAMM-3是一项开放标签、随机的头对头试验,主要终点为PFS,次要终点包括总生存率、安全性、ORR、缓解时间和最小残留疾病的评估。结果显示,该项试验没有达到PFS主要终点,Blenrep组与对照组相比的HR为1.03,mPFS分别为11.2个月和7个月,ORR分别为41%和36%。
在这一临床失败之后不久,2022年11 月 22 日,GSK 宣布,其已经应美国 FDA 的要求,启动了 Blenrep的撤市程序,这一决定基于确证性 III 期临床试验 DREAMM-3 研究的失败。受到这一影响,该产品的销售额也出现大幅萎缩,Blenrep今年上半年销售额仅为0.25亿美元。
车到山前必有路?
不过,尽管受到临床失败的打击,尽管当时业界对于这款药物的未来走向不大看好,对其略显平庸的前期临床数据以及安全性问题存在质疑,上市时FDA还公布了其“黑框警告”。并且之后又因为疗效问题在美退市,但GSK并没有放弃这一产品,而是选择继续进行试验,且在中国启动了一项III期临床试验,并仍然坚持这款药物在欧洲的销售。而此次临床成功,也印证了GSK坚持的价值。
此次DREAMM-7研究是一项随机、开放、多中心的III期临床,共纳入494名受试者,按1:1的比例随机分组接受治疗。主要终点是PFS,关键次要终点包括OS、缓解持续时间和最小残留疾病阴性率。试验达到主要终点和某些次要终点,且该试验将继续随访,具体结果将在最近举办的会议上公布。且Blenrep方案的安全性和耐受性与组合疗法中药物已知的安全性概况一致。
未来,当该产品获批二线治疗之后,或许会有更大的市场,不过BCMA靶点竞争激烈,已经上市的CAR-T、双抗都显示出不错的疗效,未来的商业化效果如何仍然有待观察。
此次事件的关键在于GSK在诸多外部条件显示利空的情况下,仍然加码临床试验,或许就在于GSK对产品和目标疾病的生物学机制有着很大的把握。当下,在许多跨国药企眼中,提高临床研发成功率的关键在于目标疾病的生物学机制进行深入而全面的探讨,建立独特的认知,获得对目标疾病深入而独特的洞察,并建立高效、规范的临床评价机制。