摘 要
许多成功的基因靶向治疗方法正在出现,用于治疗各种罕见的疾病。与此同时, 目前对神经纤维瘤病1和神经 鞘瘤病的治疗选择有限,并不能直接解决基因/蛋白功能的丧失。此外,治疗主要集中在有症状的肿瘤上,但 未能解决这些疾病中的多系统参与问题。基因靶向疗法有望解决这些限制。然而,尽管几十年来人们有着浓厚 的兴趣,但多个临床前和临床问题在成为现实之前还需要解决。基因、信使rna或蛋白质恢复和传递到适当的 细胞类型的最佳方法仍然难以捉摸。再现神经纤维瘤病1和神经鞘瘤病表现的临床前模型需要进一步完善。开 发测量动物和人体组织中神经纤维蛋白和梅林活性的有效检测方法对于早期试验至关重要,以及根据其个体基 因型和风险/收益平衡选择合适的患者。一旦基因靶向治疗有症状性肿瘤的安全性被确定,就应该探索解决广 泛的症状的可能性,包括非肿瘤表现。随着临床前工作的进行,有必要教育临床医生和神经纤维瘤病1/神经鞘 瘤病的患者了解基因靶向治疗这些疾病的风险和益处。
01介 绍
神经纤维瘤病1(NF1)和神经鞘瘤病(SWN),包括NF2-SWN、LZTR1-SWN和SMARCB1-SWN,是神经遗传性综合征,使受影响的个体易发生一系列肿瘤和非肿瘤表现(图1)。虽然这些肿瘤中的大多数在组织病理学上是良性的,但由于其数量、大小、位置和神经系统的受累性,它们可导致显著的发病率和死亡率。此外,多种非肿瘤表现可显著导致残疾,并进一步降低生活质量。在这篇文章中,我们总结了NF1和SWN基因定位治疗的主要挑战,并讨论了这些技术应用于该患者群体的途径。
目前已批准的基因射靶疗法:
基因靶向治疗,即通过各种不同的方式操纵致病性基 因变异或其产物的过程,提供了新的治疗方法几种遗传性和获得性疾病的选择,包括血液病、免疫 缺陷、癌症、传染病、眼科和皮肤病以及神经系统疾 病。截至2022年12月,美国食品和药物管理局(FDA)批准了超过27种基因治疗产品,其中5种疗法针对 单基因疾病。13 虽然这些疗法可能会改变受影响的个 体的生活,它们还从根本上改变了威胁生命的疾病 的治疗方式。基因定位治疗正在肿瘤学中进行 深入研究;然而,它在与肿瘤易感性相关的遗传条件 如NF1和SWN方面的应用仍处于起步阶段。
目前对NF1和SWN的治疗方法:
NF1和SWN的治疗集中于有症状的肿瘤。虽然手术是主要治疗,但NF1和SWN的化疗试验已经完成。 目前,唯 一被批准的专门用于NF1患者的药物是丝裂原活化蛋白 激酶激酶(MEK)抑制剂塞鲁美替尼。
贝伐珠单抗是一种血管内皮生长因子的中和抗体,被 推荐用于治疗NF2-SWN中与进行性前庭神经鞘瘤相关的听力损失。不幸的是,没有临床试验显示NF相关肿 瘤的完全影像学反应或症状的完全逆转。目前的治疗方法也未能解决这些疾病的多系统参与问题,
特别是在NF1中,因此,这并不能减轻患者所关注 的许多重要问题。此外, 目前的疗法并不治疗这些 表现的潜在遗传原因,因此未能预防未来的发病率。
基因靶向治疗提供了弥合这些差距的潜力 , 并提供比目前更全面和更有效的治疗。
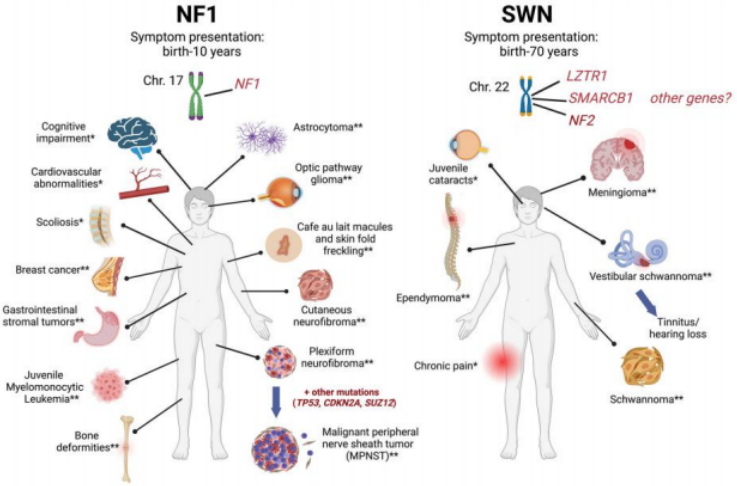 图1 NF1/SWN症状表现
图1 NF1/SWN症状表现
NF1和SWN的基因靶向治疗的基本原理和挑战
对于NF1和SWN,基因靶向治疗被设计为增加细胞中功 能蛋白的水平,这些细胞或有一个功能基因副本,称 为单倍不足细胞,或没有功能副本,定义为肿瘤抑制 基因的双倍不足细胞。虽然肿瘤的形成需要二倍体不 足,但单倍体不足会导致细胞功能异常,也可导致疾 病的表现,或通过微环境的改变促进肿瘤的进展。因此,增加功能蛋白水平为治疗已建立的肿瘤、防止肿 瘤形成和治疗这些疾病的非肿瘤表现提供了希望。
NF1是由编码神经纤维蛋白的NF1基因中的致病性变异(PVs)引起的。一些研究表明,将NF1 GRD的功能拷贝基因转移到NF1缺陷的恶性周围神经鞘瘤(MPNST) 、胶质瘤和丛状神经纤维瘤细胞中,可以抑制RAS-pERK信号并抑制生长。然而,尽管经过多年的研究,基因靶向NF1的靶向治疗仍然存在许多挑战。首先,NF1具有高度可变的家族间和家族内表型表达,可能与家族特异性的NF1pv、未知的表观遗传、环境和随机因素以及多个器官系统的参与有关。NF1的杂合性缺失和由此导致的二倍体不足是诸如肿瘤和假关节等表现所必需的,而单倍体不足可以驱动肿瘤并导致其他表型,如神经认知问题(图1)。此外,结构异常,如涉及骨骼和大脑,在确定的发育时间点后可能无法逆转。第二,神经纤维蛋白的表达在不同的细胞类型和组织之间存在差异,需要避免严格 调控转基因表达RAS-MAPK信号通路和细胞命运的改变,导致潜在的严 重并发症。可变的组织分布还涉及到独特的神经纤维 蛋白亚型,这是由选择性剪接产生的。最常见的亚型1(2818 aa)和2(2839 aa)的差异在于在GTPase 激活蛋白(GAP)相关结构域(GRD)中插入21-aa(外 显子30alt31,以前为23a),这导致亚型2的GTPase活 性显著降低。值得注意的是,亚型2的缺失或改变亚型1与2的比例可能分别导致小鼠的学习障碍或神经元分化紊乱。最后,目前尚不清楚有多少神经纤维蛋白必须被恢复, 以及在哪个时间点可以显著改变细胞的命运或条件。
治疗NF2-SWN患者的主要挑战是,NF2基因产物梅林 的确切功能仍不完全清楚。梅林在细胞发育和肿瘤发 生中具有多种作用,阻止直接靶向NF2的上下游细 胞信号通路,从而指出直接靶向NF2基因的策略。在SWN的其他分子亚型中,个体在SMARCB1或LZTR1(或其 他未知基因)中存在种系pv,但它们在神经鞘瘤肿瘤 发生中的作用尚未确定。大多数综合征性神经鞘瘤,无论是归因于NF2、SMARCB1或LZTR1中的种系PVs,都携带NF2基因的双等位基因失活,这表明它对雪旺细胞 肿瘤的发生是必要的。因此,SMARCB1-、LZTR1 -和NF2-SWN患者的肿瘤都可以从NF2基因替代治疗中获 益,但需要注意的是,非NF2-SWN个体的每个神经鞘瘤都携带一个独特的体细胞NF2 PV。此外,患者还表现为非肿瘤表现,如NF2-SWN白内障和SMARCB1和LZTR1-SWN神经性疼痛,梅林在受影响组织中重表达的疗效尚不确定。
与NF1类似,不同的细胞类型会导致神经鞘瘤、脑 膜瘤和室管膜瘤;这就需要定义最佳的治疗靶细胞,以避免不必要的脱靶组织暴露和优化治疗窗口。在正常(梅林表达)组织中,细胞对梅林过表达的反应尚不清楚。此外,NF2-SWN患者是梅林/NF2半合子的,而SMARCB1或LZTR1 PVs患者除肿瘤外,全身的梅林水平正常。
目前研究的是NF1和SWN的基因靶向治疗方式
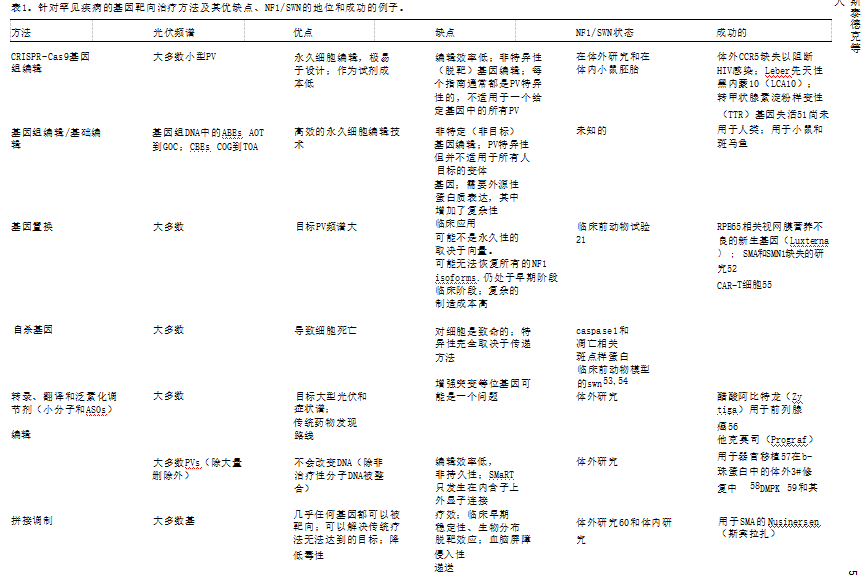
有许多潜在的基因靶向治疗方法和策略,最近已经被 彻底的回顾和详细讨论。因此,我们提供了一 个简要的概述。了解每个方法工作告知选择特定的pv,最合适的治疗,组织和表现。基因组编辑可以用来改变核苷酸序列或目标DNA碱基的化学性质。这些变化发生在逐个碱的基础上 , 并且高度个性化,几乎每种类型的PV都设计了新的试剂。另外,可以在基因替代治疗中引入额外的DNA拷贝(编码一个基因的全部或重要部分),要么恢复基因功能(对于大多数功能丧失的变异),要么作为自杀基因治疗,杀死独立于PV的靶细胞。另外,小分子和反义寡核苷酸可以靶向转录和翻译增强子,以增加剩余的野生型等位基因的蛋白质表达,或调节蛋白质降解,每一个最终产生更多功能的蛋白质。在RNA水平上,靶mrna可以使用反式剪接核酶进行编辑或SMaRT(RNA模板的5#端开关机制)技术,一种不会永久改变基因组的策略。mRNA的剪接,以及miRNA的功能,也可以被反义寡核苷酸调节 , 以以靶向的方式控制基因的表达。虽然mRNA的编辑和剪接也是高度个性化的,但它们在杜氏肌萎缩症或脊髓性肌萎缩症的儿童患者中具有良好的耐受性。无义变异,导致可忽略的全长蛋白表达,可以被无义抑制治疗所靶向,它使用靶向翻译机制的小分子来恢复全长功能蛋白的翻译。最后,蛋白质可以被替换,修饰化合物可以用来易位、稳定或帮助恢复缺陷功能。我们详细地考虑了每一种模式,并详细阐述了其优点和缺点优势,NF1/SWN的状态,以及表1中临床成功的例子。
交付向量平台
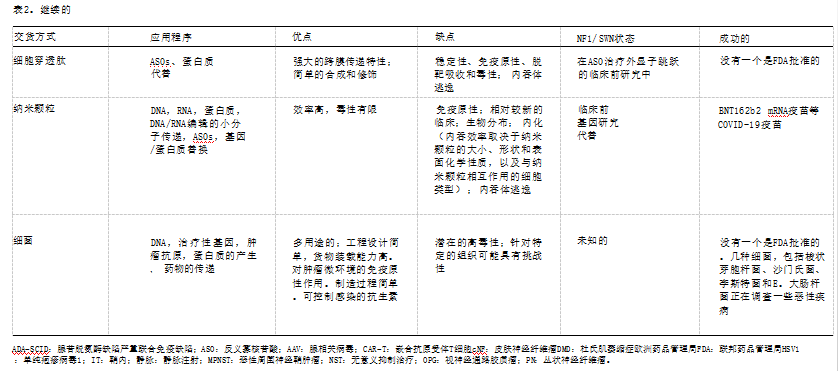
因靶向治疗的细胞内传递仍然是这些治疗的临床转化的一个主要障碍,治疗的安全性和有效性在很大程 度上取决于用于将遗传物质或货物传递到靶细胞的载体。除了传统的小分子化合物(由于小尺寸或亲脂性而穿过细胞膜)之外,其他的递送策略包括病毒和非 病毒方法。常见的病毒载体包括腺相关病毒、腺病毒 、慢病毒/逆转录病毒和单纯疱疹病毒1。腺相关病 毒是最常用的载体,因为它们可以感染多种脊椎动物 , 包括人类和非人类灵长类动物,可以被设计成增加组织向性,并且自然存在复制缺陷,这是一个对它们非常有利的显著特征用作传递向量。非病毒性方法包括细胞穿透肽、纳米颗粒和细菌。我们详细考虑了每种方法,并详细阐述了每种方法的优缺点,它们对NF1/SWN的状态,以及表2中的成功例子。
一些主要的传递问题包括转基因能力、组织向性和 转导效率(遗传物质转移到感兴趣的细胞的速率或水平) 。通常,货物的大小是选择最佳交货方法的一个决定因素。
例如,NF1基因的大小远远超过了目前腺相关病毒载体(~4.7kb),因此除非使用分裂载体系统 或微型基因方法,否则无法通过腺相关病毒进行全长 基因置换。此外,由于不同的靶组织可能是NF1和SWN的特定表型的基础,理想情况下,治疗货物是针对特定的细胞类型(s),以最大限度地提高疗效和 最小化脱靶积累和毒性。因此,各自载体的向性或靶 向性可能将其临床应用限制在一个狭窄的症状范围内。最后,靶细胞的转导效果不佳可能导致未转导的肿瘤细胞的生长。
在NF1和SWN模型中的临床前测试
理想情况下,基因靶向治疗方法应该在基于人类pv的动物模型中进行测试,并在生长速率、位置和治疗反应方面概括肿瘤自然史(模型验证)。然而, 由于人类NF1和NF2pv的多样性,对基因型-表型相关性的了解有限,以及实验诱导的失活种系pv的类型/机制,动物 只能部分再现人类疾病,并表现出有限的表现谱(表3 ) 。因此,在进行人体试验之前,可能需要一个广泛的模型范围。小鼠模型已被用于一些基因治疗研究,作为初步的临床前评估平台,包括癌症、血液学和神经系统疾病。一些小鼠模型来模拟Nf1位点的杂合性缺失(i。e. 导致肿瘤形成的第二个基因步骤)。一般来说,研究使用的是基因功能失活的基因敲除小鼠。然而,小鼠需要精心的基因操作,通过细胞类型和组织特异性cre驱 动程序“条件 ”敲除Nf1来产生临床表型, 以产生特定 的疾病特征(表3)。广泛使用的丛状神经纤维瘤模型 使用Dhh-Cre沿着脊髓产生神经纤维瘤,使雪旺细胞前体中的Nf1基因失活;这个模型提供了关键赛鲁替尼作为丛状神经纤维瘤的临床前数据。当在表达Sox10-或hoxb7的细胞中删除Nf1时,Nf1的细胞特 异性缺失也可产生皮肤神经纤维瘤和丛状神经纤维瘤,或在Prss56表达细胞中;76,89类似的策略也可 以用来模拟神经胶质瘤,髓系白血病、嗜铬细胞瘤和非肿瘤表现,如色素沉着,或骨、血管或神经认知异常。重建患者特异性种系pv的下一代小鼠模型现在可以用于测试基于特定基因改变类型的治疗方法;然而,到目前为止,没有一个小鼠模型完全概括人类表型(表3)。


一些NF2SWN和SMARCB1-SWN的基因工程小鼠模型已经生成,这些模型发展为具有与人类相似的组织学和临床特征的神经鞘瘤。由于这些模型概括了神经鞘瘤 生长缓慢和惰性的性质,它们的临床前治疗窗口相当大,需要几个月的随访。基于nf2缺失细胞移植的小鼠 模型提供了更快的读数,但由于肿瘤细胞转化(获得了额外的遗传变异),它们的快速生长性质可能会影 响对梅林再引入的治疗反应。因此,应该根据平移问 题来选择最相关的模型。例如,基因治疗对nf2-单倍 不足细胞(非肿瘤细胞)的毒性应该在Cre;Nf2中进行分析ko/flox模型,而不是在Cre;Nf2中flox/flox或异种移植模型。使用具有生理和代谢的大型动物模型(猪)可以提 高临床前试验的预测性。猪模型可以很好地评估不 同的分娩方法和毒性研究,正如在脊髓性肌萎缩症和 杜氏肌萎缩症中所显示的那样,而较低的物种(小鼠)可以用来解决生物学/机制上的问题。在NF1中,存在两种特征相当明确的猪小猪模型,表现为皮肤神 经纤维瘤、神经认知症状和视神经通路胶质瘤的临床 特征;在NF2-SWN中,一种新的猪迷你猪模型目 前正在鉴定中。使用猪研究的重要考虑因素包括:高成本、某些疾病表现的低流行率(可能模仿人类),以及临床前研究所需的延长时间(与啮齿动物研究相 比)。
最后,非人类灵长类动物在基因治疗的评估中发挥了重要作用,因为它们在基因上最接近人类。它们的神经系统和解剖结构与人类相似,使其成为评估针对NF1和SWN的基因治疗的生物分布和安全性的关键模型;然而,建模NF1和SWN的非人类灵长类动物目前还不存在。因此,利用这些模型来评估疗效不仅需要精确的模型开发,而且还需要广泛的表型特征分析,包括自然史研究。值得注意的是,非人类灵长类动物模型的批准并不需要,也可能对NF相关的基因治疗工作不是必需的。
与NF1和SWN的基因定位治疗相关的疗效考虑
基因靶向治疗的治疗目标包括稳定、缩小或预防肿瘤 , 以及治疗非肿瘤表现。鉴于这些遗传条件的罕见性 , 随机试验是不实际的。因此,适当的对照很可能来 自于NF1和NF2的自然史研究,这些研究已经前瞻性地 监测了疾病的表现。选择基因靶向治疗临床试验的参 与者将需要基因分型来确认和分类pv。应用英国NF2遗 传严重程度评分或修订后的功能遗传严重程度评分可能有助于定义纳入标准和反应标准。
NF1和SWN同时是单基因疾病和肿瘤抑制综合征。有效的基因定位治疗将需要解决与导致疾病表现的种系和体细胞遗传事件相关的几个关键问题。对于NF12/2或NF22/2二倍体组织不足(e。g.神经纤维蛋白或梅林水平的(部分)恢复是否可以缩小或消除肿瘤?如果是这样,那就需要多少蛋白质了?在肿瘤发展的哪个阶段?相反,对于显性阴性变异,什么程度的RNA/蛋 白质抑制对肿瘤有意义地影响肿瘤?考虑到NF1/SWN中 肿瘤类型的范围,基因靶向治疗是否需要具有组织特异性?对于NF1+/ 2或NF2+/ 2单倍体组织不足(e。g. 正常的雪旺细胞或蛛网膜帽细胞在随后的体细胞失活 事件后可引起神经纤维瘤、神经鞘瘤和脑膜瘤),杂合子组织中的神经纤维蛋白或梅林的(部分)恢复能否 防止或延迟肿瘤的形成?对于与非肿瘤性疾病表现相 关的单倍不足组织(e。g.NF1中的学习/社交缺陷、疼痛和骨密度;以及NF2-SWN中的幼年白内障),神经纤 维蛋白和梅林的重新表达能否逆转疾病的表现?
对于NF1,靶点最初应关注发病率和死亡率最高的肿瘤,如丛状神经纤维瘤、MPNSTs、高级别胶质瘤和视神经通路胶质瘤。皮肤神经纤维瘤几乎影响所有患者并导致显著的毁容,可能是另一个吸引人的目 标,因为与丛状神经纤维瘤不同,这些肿瘤不是先天性的,通常发生在青少年和成人,而不是儿童。这些病变可在皮肤上到达,便于组织进入和监测,并可能提供机会探索非全身给药,如反复局部应用单纯疱疹病毒1治疗营养不良的大疱性表皮松解症。携带NF1双等位基因失活的雪旺细胞被认为是神经纤维瘤的致瘤细胞,可能是野生型NF1或特异性杀死NF1缺陷细胞的转基因表达增加的靶向细胞。另外,靶向单倍不足的肿瘤微环境可能有助于延缓或逆转肿瘤的生长。NF1基因替换、无义抑制治疗以及通过反义寡核苷酸调节转录和翻译是未来十年人类研究的有利方法。
基因组编辑和蛋白质替代仍然是很有吸引力的选择,但在启动临床试验之前还需要更多的开发。NF1恶性肿瘤为基因定位治疗提出了额外的挑战。NF1的功能恢复可能不能治愈SUZ12、CDKN2A/B和TP53中含有其他体细 胞变异的mpnst,或者是具有TP53和PTEN体细胞变异的高级别神经胶质瘤。
由于NF2-SWN的显著死亡率,初步的努力应集中在这种SWN亚型上。由于NF2-SWN表现出基因型-表型相关性,外显子2至13的结构截断pv最为严重,临床发展 可能集中于针对这些变异,例如通过无义抑制或基因 替换。94鉴于NF2的双等位基因缺失在NF2相关的SWN 、LZTR1和SMARCB1相关的SWN的肿瘤中是常见的,似乎在NF2-SWN中开发的治疗方法也可能适用于SWN的其他亚型。与NF1一样,NF2-SWN的初步靶点是可能会重点关注发病率和死亡率最高的肿瘤:颅内脑膜瘤和前庭神经鞘瘤。非前庭神经鞘瘤,特别是当考虑到高度病态的脊髓和颅神经病变,是另一个感兴趣的目标。中枢神经系统肿瘤可能采用局部给药方法 (脑内或鞘内),最近使用溶瘤性单纯疱疹病毒G47D证实了复发性局部病毒给药的可行性,具有良好的安全性和生存效益。与NF1一样,NF2基因替换、无义抑制治疗以及通过反义寡核苷酸调节转录和翻译是临床试验中有吸引力的方法,而基因组编辑可能需要在 人类研究之前取得重大进展。



虽然有症状的肿瘤仍然是NF1/SWN的主要焦点,但广泛的非肿瘤表现也显著影响生活质量,可以通过基因靶向治疗进行探索。NF1的神经认知特征,包括学习 、注意力和社交缺陷,在一定程度上影响了大多数人 , 导致了学业成就和社会关系的挑战。脑解剖和小鼠研究表明,神经纤维蛋白的丢失可以改变神经胶质祖细胞的胚胎迁移和分化,并导致普遍的髓鞘功 能障碍,这可能会限制针对神经认知表现的基因 治疗的疗效。另一方面,NF1中RAS/ERK信号通路的下调+/ 2小鼠挽救了注意力、工作记忆和学习缺陷,因此在后期阶段,神经纤维蛋白的上调可能仍然是有益的。这一点得到了临床观察结果的支持MEK抑制剂治疗可能对5-27岁NF1患者的神经认知功能 有积极影响。然而,考虑到儿童的发病、神经认知表现的可变性, 以及非nf1相关的神经认知原因的可能性,招募可能会推迟人体试验。NF1和SWN发生局部和广泛性疼痛,对生活质量产生不利影响,医疗和手术干预有不同的好处。由于赛鲁美替尼可以减少NF1中的肿瘤疼痛,因此肿瘤定向的基因靶向治疗可能 也显示出类似的益处。
基因靶向治疗的早期临床试验的安全性考虑
基因靶向治疗的前景已经被有关安全担忧的历史现实所削弱。NF1/SWN的早期临床试验必须解 决与特定转基因和细胞传递方法相关的安全问题。对于基因替代治疗,由于NF1或NF2作为肿瘤抑制因子的功能,其过表达可能会产生负面后果。增强蛋白表达对NF1/nf2充足、NF1/nf2-单倍不足和NF1/nf2-二倍不足细胞的比较影响尚不清楚,特别是在不同的时间框架内。其他转基因引起了对肿瘤细胞靶效应特异性和肿瘤细胞脱靶效应特异性的关注。
神经纤维蛋白或梅林过表达对这两种NF1的潜在短期和长期后果尚不清楚+/ 2或NF2+/2单倍体组织不足(e。g.在NF1或NF2-SWN中无疾病表型的组织)和 NF1+/+或NF2+/+在NF1或SWN镶嵌的患者体内有足 够的组织。同样,在全身梅林水平正常的非nf2SWN患 者中,梅林过表达(以收缩或预防肿瘤)的后果尚不 清楚。要了解过表达如何影响这些组织,就需要使用 临床试验,而临床前模型可用于在让患者接受基因靶 向治疗之前获得有价值的见解。
基因替换的其他安全问题与整合到宿主基因组中的 病毒载体有关,如慢病毒载体。这些载体可以激活或不活跃附近的基因,从而产生肿瘤克隆。此外,它们可以在给药后在组织中持续数年,而且它们的作用可能是永久性的。这一特性对于病情严重或日后有可能患上严重疾病的NF1/SWN儿童尤其重要。这些儿童从基 因靶向治疗中获益最大,但考虑到他们的预期寿命,出现长期并发症的风险最高。FDA要求长期了解这些产品的真实安全性的定期监测计划。
此外,大多数病毒载体在反复注射时都有可能引起免疫反应。在某些情况下,这种免疫反应可能是可取的(e。g.来刺激肿瘤中的免疫反应)。在其他情况下, 它可能会限制疗效,产生不良事件(i。e. 自身免疫性疾病),或限制使用相同载体进行后续治疗的能力。考虑到在NF1和SWN中发生肿瘤的终身风险,再治疗与基因定位治疗可能是可取的。使用细菌或病毒载体也增加了这些载体在体液中脱落的可能性,从而使其他载体面临感染风险。最后,分娩途径的选择是一个关键问题,并取决于目标症状、载体、位置和适应症(预防vs症状) 。静脉给药可能适用于非肿瘤表现、弥漫性疾病(e。g.多发性肿瘤或转移性MPNST),或当考虑到症状预防时。 然而,静脉给药需要大剂量的载体来实现靶组织转导 。高剂量可能会增加毒性和菌株制造能力,从而减缓临床转化。通过鞘内注射直接给药到中枢神经系统更有效,在相对较低的载体剂量下实现了在整个大脑和脊髓的有效转导。该方法可能适用于神经认知症状和脑、脊髓和神经根的肿瘤。最后,局部或局部基因转移可能适用于孤立和可及的肿瘤。这种方法降低了全身毒性的风险,并由于免疫原性降低而支持重复使用病毒载体。
结论
基因靶向治疗对NF1/ SWN有巨大的前景。成功的一个关键的临床前障碍包括定义能够充分靶向感兴趣的组织并在正确的时间恢复功能蛋白的方法;治疗方法可能因基因型、靶症状和适应症而有所不同。一个关键的临床障碍包括识别一组具有适当基因型的患者,这些患者有足够的风险来获得相应的利益,同时避免暴露于不太可能受益的个体。随着基因靶向治疗的临床前研究的进展,更广泛的NF1/SWN社区需要继续围绕基因靶向治疗的类型和与之相关的潜在风险进行讨论,以便为早期临床试验做准备。
致谢:作者感谢儿童肿瘤基金会对发表这篇手稿的支持。作者感谢 白仁源博士的科学投入。作者承认,图1是用生物渲染器创建的。
利益冲突的声明:作者(s)声明了与本文的研究、作者身份和/或发表有关的以 下潜在的利益冲突:V。S.担任吉尔伯特家族基金会基因治 疗计划的科学顾问。H.S.他是固定生物科学公司的创始人/ 首席执行官,这是一家针对NF1的早期药物发现公司。R.K. 担任固定物生物科学公司的科学顾问。(加利福尼亚州圣地 亚哥梅里菲尔德街3210号,邮编92121)。Y.K.担任吉尔伯 特家族基金会的科学官员,以及NTAP基因治疗项目的科学顾 问小组成员。S.R.P.他是NF选择治疗公司和NF2治疗公司的 联合创始人,也是阿斯利康、索纳利斯公司和阿库乌斯公司 的咨询公司。B.K.是基因组医学、复发、海尔克斯和弹簧工程的顾问。
资金:作者(s)披露了收到了对本文的研究、作者身份和/或发表的 以下财政支持:V。S.由NTAP的基因治疗计划、美国国家癌 症研究所(NCI)(5K08CA230179和1U01CA247576)和桑塔 格杰出科学家奖支持。D.B.,J.A.W., A.L.和D。W.是由 吉尔伯特家族基金会基因治疗计划提供的支持。J.A.W.是由 儿童肿瘤基金会的基因治疗计划资助的。M.G.和J。V.由NF2 治疗公司支持。M.G.获得了美国国防部CDMRP NFRP(W81XWH 2110448)的支持。J.V.由儿童肿瘤基金会的药物发现倡 议(2020-05-004 )资助 。B.K.是由美国国立卫生研究 院和美国国防部资助的。D.W.和R。K.由NCI(R01CA26593) 支持。
ORCID iD:卡拉·安斯泰特https://orcid。米兰达
Lhttps ://or cid。org/0009-0001-5390-0518
HerbSarnoffhttps://酸。jeremie/0000-Vittehttps ://orcid。org/0000-0002-2567-7988 迪安·沃利斯https ://orcid。org/0000-0002-8217-0892

《参考文献》
人划线