1999年,患有严重遗传病鸟氨酸转氨甲酰酶缺乏症的18岁少年 Jesse Gelsinger,在接受宾夕法尼亚学 James Wilson 教授主导的腺病毒基因治疗临床实验后,发生严重免疫反应后死亡,成为第一个因基因治疗而死的人。
悲剧发生后,James Wilson 教授开始寻找更安全的病毒载体,最终他们开发并推广使用了腺相关病毒(AAV)。AAV具有安全性好、宿主细胞范围广和体内表达时间长等优点,成为目前应用最广泛的体内基因治疗载体。然而,靶向肝脏的AAV基因疗法还面临着转入基因表达效率和表达持久性有限的挑战。AAV通常被认为以游离态存在于细胞中,但有时候也会插入整合到宿主细胞基因组中,这可能是宿主细胞在DNA修复过程中无意导致的。但这也导致人们担心AAV载体可能破坏宿主细胞基因组并导致癌症。2023年11月6日,James Wilson 教授团队在Nature Biotechnology 期刊发表了题为:Integrated vector genomes may contribute to long-term expression in primate liver after AAV administration 的研究论文。图1:来源于 Nature Biotechnology官网
同一天,James Wilson 教授团队还在 Human Gene Therapy 期刊发表了题为:Prevalent and Disseminated Recombinant and Wild-Type Adeno-Associated Virus Integration in Macaques and Humans 的研究论文。
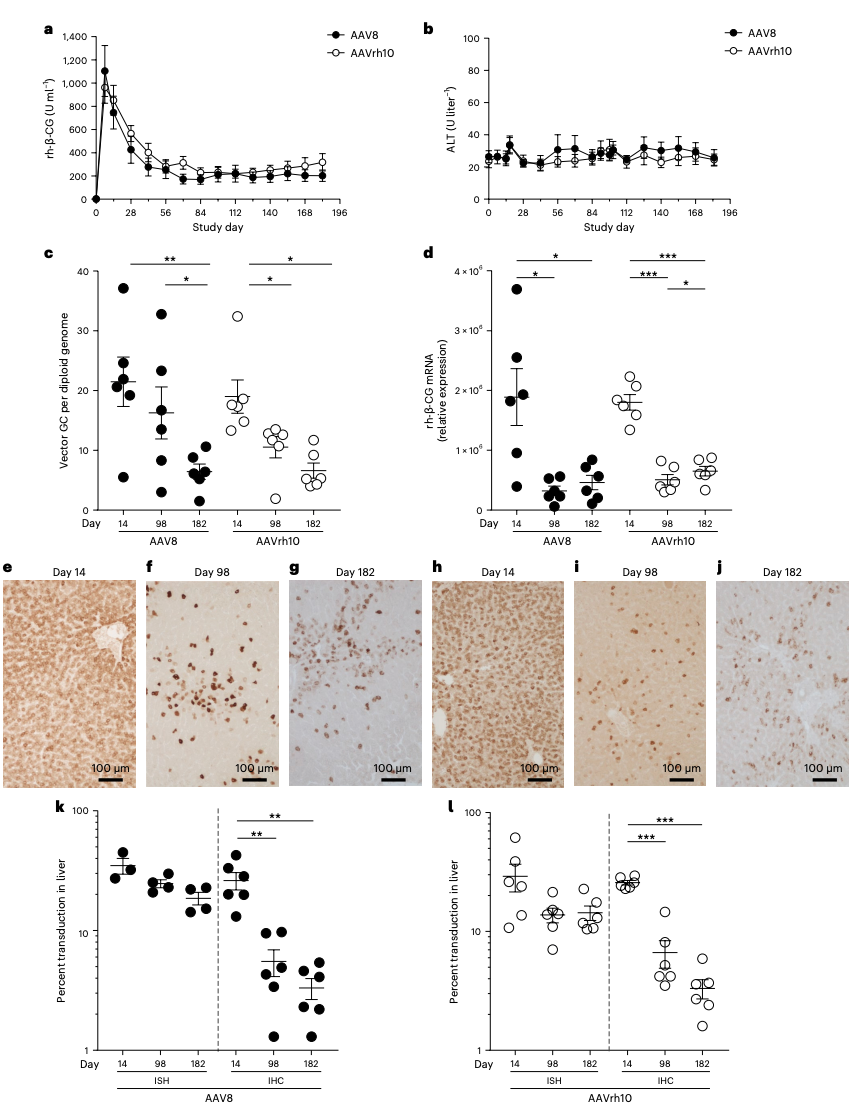
图2:来源于 Human Gene Therapy 官网这两项研究是迄今为止在非人灵长类动物中进行的关于AAV对宿主基因组整合的最全面探索,对AAV基因治疗的安全性和长期疗效具有重要意义。该研究表明了靶向肝脏的腺相关病毒(AAV)整合到宿主细胞基因组中,提供了长期持久表达的潜力,而不太可能驱动致癌突变。之前的靶向小鼠(尤其是新生小鼠)肝脏的AAV基因治疗的研究发现,AAV载体基因组的插入整合可以通过破坏基因组中阻断癌症的调控元件而引发肝癌。但这种情况是否也会发生在人类和其他灵长类动物身上还不清楚。在发表于 Human Gene Therapy 期刊的论文中,研究团队检查了86只猴子的组织样本(主要是肝脏样本),这些猴子在临床前试验中接受了基于AAV的基因治疗,还检查了253个从未接触过工程化AAV的猴子和人类(168只猴子、85个人类)的组织样本(主要是肝脏样本)。结果显示,这些接受工程化AAV基因治疗的猴子,以及只接触过野生型AAV(自然界中存在的天然AAV)的猴子和人类,AAV在整个基因组中以以随机分布的方式插入的概率很低,扩展风险也很低,即使在AAV基因治疗15年后的猴子体内也是如此。在发表于 Nature Biotechnology 期刊的论文中,研究团队对12只猴子进行了两年多的跟踪研究,这些猴子接受了靶向肝脏的AAV基因治疗。靶向肝脏的腺相关病毒(AAV)基因疗法已被批准用于治疗血友病A型和血友病B型,此外,还有许多靶向肝脏的AAV疗法处于临床开发后。然而,靶向肝脏的AAV基因疗法存在两大挑战——一个是AAV在肝脏中的持久性,另一个是难以再次给药。之前在血友病B型的AAV基因治疗临床研究表明,治疗的前2个月内疗效就开始下降。此外,Crigler-Najjar综合征(一种隐性遗传的高胆红素血症)患者接受AAV基因治疗后,血清胆红素会立即降低,但2个月内又会恢复到治疗前水平,患者没有明显的AAV载体免疫或肝脏炎症,这表明可能是非免疫机制导致的疗效丧失。然而,在持续几个月的表达不稳定期后,非人灵长类动物(NHP)和人类肝脏中的AAV表达水平会保持在一个较低水平,这令人惊讶,因为肝细胞会不断分裂更新,理论上游离的AAV基因组应该不断被稀释才对。为了搞清楚其中的原因,James Wilson 教授对非人灵长类动物(NHP)静脉注射的AAV8和AAVrh10载体,进行了超过2年时间的观察和评估,以更好地定义影响基因治疗效果的AAV转导机制。研究结果显示,非免疫原性转基因的高度转导得以实现,尽管表达在前90天内开始下降,并达到一个较低但稳定的表达状态。超过10%的肝细胞仍存在AAV载体DNA的单核结构域,尽管其转入的基因表达可能已经丢失。而免疫原性转基因观察到AAV载体DNA和RNA的更大程度的减少。此外,在基因组的不同位置,整合到染色体中的AAV载体序列的频率很低,而且这些位置均与肝癌相关基因不相近,并在随访的几年里没有明显克隆扩张的证据。图3:本文所述论文附图
这些结果表明,在灵长类动物肝细胞中,AAV介导的转基因表达发生在两个阶段:首先,来自游离的AAV基因组的高水平但短时间的表达;然后是低水平但持续稳定的表达,这表明灵长类动物肝脏中AAV基因治疗的持久性可能是由于AAV载体的整合。
https://www.nature.com/articles/s41587-023-01974-7https://www.liebertpub.com/doi/10.1089/hum.2023.134