
陆英明博士
“MDS患儿症状包括婴儿性肌张力低下、智力残疾、癫痫、运动技能丧失和死亡,目前没有可用的治疗手段,MDS存在着巨大的亟待满足的临床需求。”辉大基因联合创始人、首席执行官陆英明博士表示,“HG204是公司今年第二个获得美国FDA批准RPDD的项目,也是公司神经类项目获得的第一个RPDD。辉大团队将积极推动HG204的临床开发,为患者带来真正临床获益,更为MDS家庭带来希望,更努力实现辉大惠及全球患者的美好愿景。”
由FDA发起的RPDD和优先券计划,是对儿科罕见病疗法的重大需求的认可,旨在鼓励这些严重或危及生命的疾病新疗法的开发。在该计划下,申办方在罕见儿科疾病新药上市申请(NDA)或生物药上市许可申请(BLA)获批后将有资格获得优先审查券(PRV)。PRV可以被用于后续任何产品上市申请时的6个月加速审评,也可以被出售给第三方。

姚璇博士
“我们很高兴收到来自美国FDA对HG204这一全球首个CRISPR RNA编辑治疗MDS药物的积极重要的监管反馈,彰显了该疗法对MDS儿童患者的重要临床价值。”辉大基因联合创始人、总裁兼大中华区总经理姚璇博士说,“HG204项目是辉大自主开发的基于CRISPR/hfCas13Y的RNA编辑疗法, 用于靶向MECP2 mRNA以治疗MDS。临床前研究数据表明,HG204在MDS小鼠模型中可有效降低MECP2表达水平,恢复运动功能,并显著延长寿命。我们期待早日将HG204项目推上临床,解决这种遗传性儿科疾病的迫切临床需求,同时辉大将继续坚定不移地开发变革性的基因治疗策略和药物,挽救患者生命。”
|关于辉大基因
辉大(上海)生物科技有限公司(下称“辉大基因”)是一家全球性的临床阶段生物技术公司,专注于设计、改造及开发新型CRISPR基因编辑工具和颠覆性的创新基因疗法。
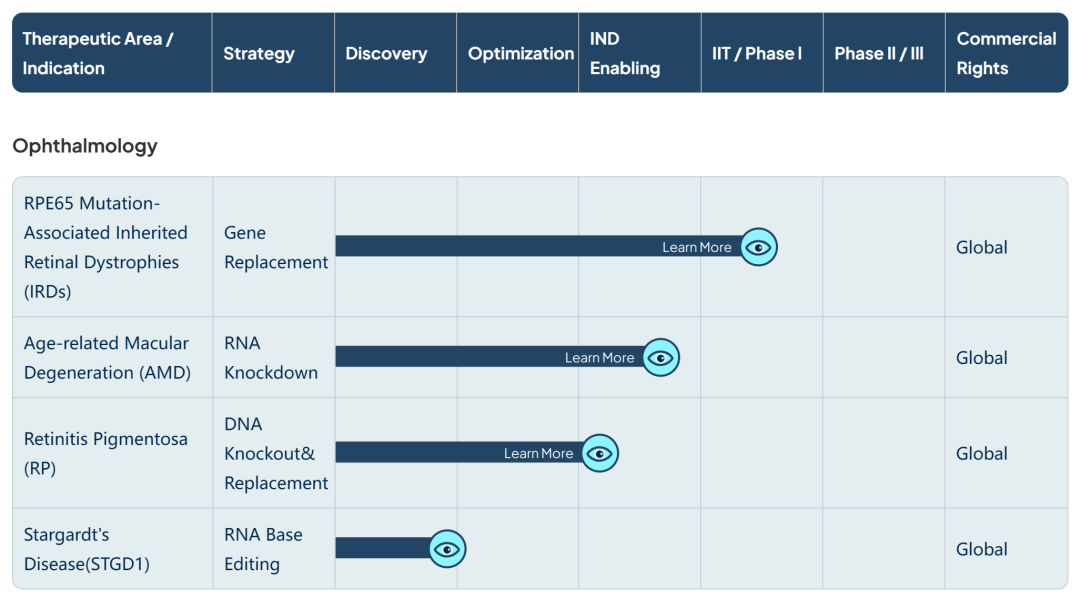
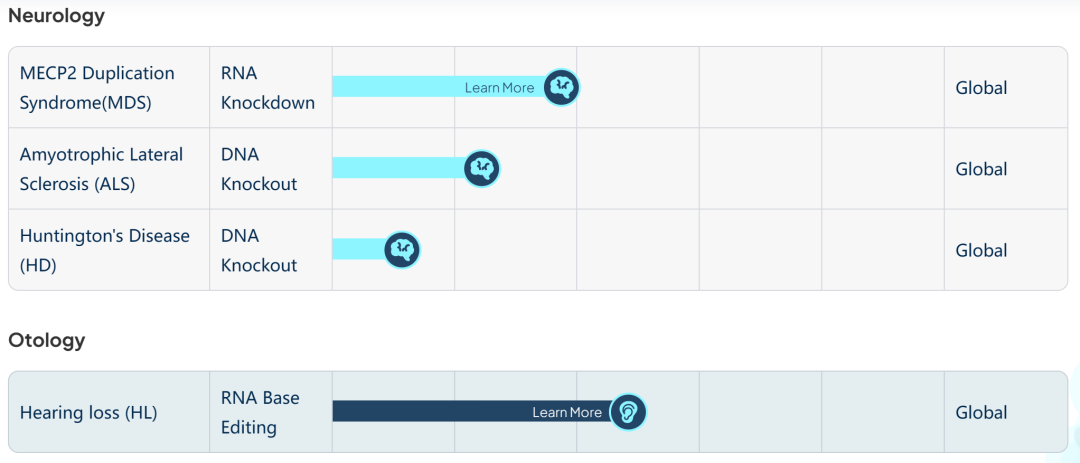
研发管线涵盖眼科、中枢神经等多个领域。公司临床阶段项目包括HG004治疗RPE65突变相关遗传性视网膜疾病(已获得美国FDA授予孤儿药资格认定和儿科罕见病资格认定)和HG202( CRISPR/Cas13 RNA编辑疗法)治疗新生血管性年龄相关性黄斑变性(nAMD)等项目。
在研管线

参考资料:
辉大基因