
KYV-101是一种新型的全人源CD19 CAR-T 细胞疗法,其特性尤其适用于治疗B细胞驱动的自身免疫性疾病,如狼疮性肾炎、系统性硬化症和炎性肌病。在临床前研究证明,该疗法可在疾病模型的血液循环和组织中深度诱导和B细胞的完全耗竭,产生显著疗效。
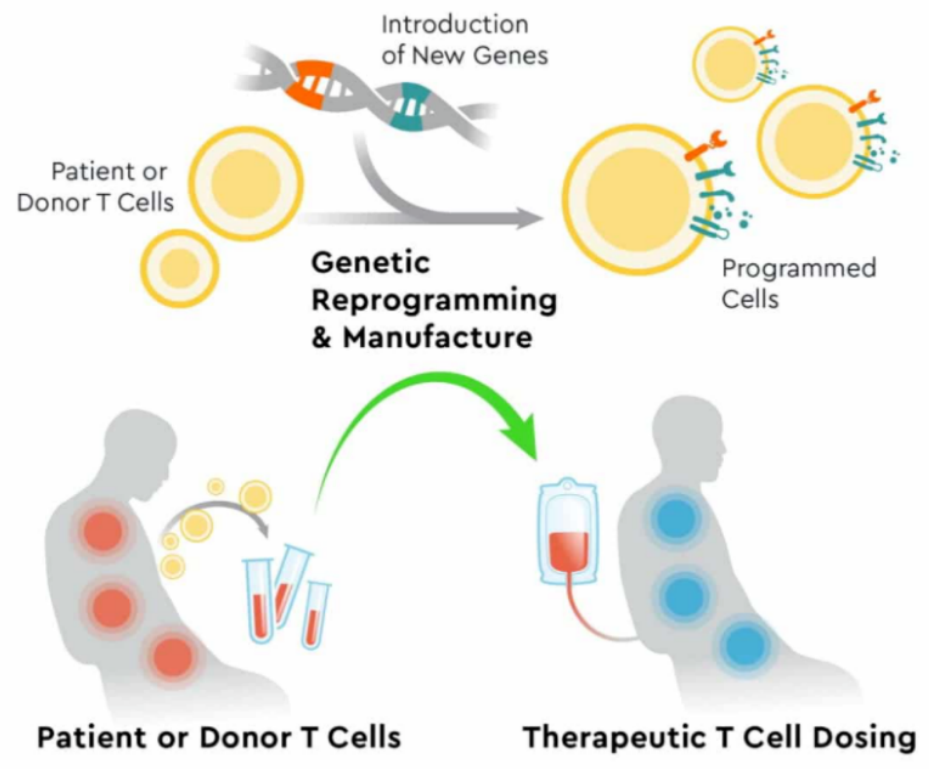
针对免疫系统的CAR-T细胞疗法
(图片来源:Kyverna官网)
此外,这种CAR-T构建体将提高传统CD19 CAR-T的耐受性,具体来说,KYV-101采用完全人源化的CD19 CAR与合理的共刺激结构域相结合,在包含20名患者的1/2期肿瘤学研究中,KYV-101极大限度地减少细胞因子的释放,且严重神经毒性的发生率降低了10倍。
Kyverna的管线研发
Kyverna是一家为严重自身免疫性疾病设计新型疗法的细胞治疗公司,其专有的synReg T 细胞平台,该平台利用合成生物学,将T细胞重新编程,生成CAR-Treg细胞,这种细胞可以特异性靶向疾病组织,让Treg细胞在疾病组织通过多种免疫抑制机制,抑制自身免疫性疾病。
Kyverna现拥有两款抗CD19 CAR-T细胞疗法,除了KYV-101外,与Intellia Therapeutics共同开发的在研候选产品KYV-201,也用于治疗特定B细胞驱动的自身免疫性疾病。该疗法将结合Kyverna靶向CD19的创新嵌合抗原受体,与Intellia基于CRISPR/Cas9的体外同种异体基因编辑技术平台。
CAR-T自免适应症扩展路
CAR-T疗法在白血病、淋巴瘤和骨髓瘤等血液类癌症中取得了强大疗效。不过,该领域正在悄然发生一场革命:开始挣脱肿瘤的“捆绑”,向自身免疫性疾病开辟新的创收途径。与CAR-T疗法相比,其他靶向B细胞的生物疗法只能抑制B细胞的成熟及增殖,而不能完全清除自身异常B细胞,而且只能一次性与B细胞靶点结合,不能自我再生,所以患者需要长期服药。而CAR-T不仅可以定点清除自身异常B细胞,还有望实现免疫重启。同时具有自我复制增殖的能力,可长期监视体内异常B细胞,可以在体内存在几个月甚至两三年的时间,防止疾病复发。
其中关联性最强的疾病为系统性红斑狼疮(SLE),此外还有硬皮病、肌炎、肾病、视神经脊髓炎谱系障碍等,这些疾病在近期的CAR-T研究中都有重大的突破。
系统性红斑狼疮(SLE)
CAR-T用于治疗SLE纯属偶然。医生在使用CAR-T疗法治疗同时患有白血病和SLE患者时,发现患者的两种疾病同时被治愈。2022年9月,Georg Schett教授研究团曾经在Nature子刊上发表了一篇题目为“Anti-CD19 CAR T cell therapy for refractory systemic lupus erythematosus”的研究论文,报道了CAR-T细胞治疗难治性SLE引起业界广泛关注。
2022年11月23日,CAR-T之父Carl H.June教授在Cell期刊上发表综述——“CAR T therapy extends its reach to autoimmune diseases”,并在文中指出SLE可能比B细胞肿瘤更容易成为CAR-T细胞治疗的靶点,因为在SLE中疾病驱动的B细胞数量要少得多,因此,CAR-T治疗SLE这一自身免疫疾病可能只需要更低的剂量,这将大大减少CAR-T细胞治疗的不良反应。

图片来源:[4]
2023年4月7日,CDE官网公示,药明巨诺自主开发的瑞基奥仑赛,其新适应症获批临床,用于治疗中重度难治性系统性红斑狼疮SLE。此次获批意味着CAR-T免疫细胞疗法有望成为中重度难治性SLE的新选择,也开启了免疫细胞治疗癌症以外的其他疾病的新大门。

今年5月15日,亘喜生物宣布在中国启动一项全新的、评估旗下BCMA和CD19双靶点自体CAR-T细胞疗法 GC012F治疗SLE的由研究者发起的临床试验(IIT)。GC012F融合了多项新一代CAR-T技术,包括CD19/BCMA双靶点设计以及FasTCAR"次日生产"技术,开创性地将CD19/BCMA双靶点CAR-T疗法应用于系统性红斑狼疮,相较于CD19单靶点CAR-T疗法,旨在更深入、广泛地清除产生自身抗体的B细胞和浆细胞,有望进一步提高疗效。

今年8月15日,Impact Bio宣布FDA批准其开发的IMPT-514疗法的IND申请。IMPT-514是首个用于治疗系统性红斑狼疮的双特异性CD19/CD20 CAR - T疗法,FDA批准IMPT-514启动临床研究标志着Impact Bio自身免疫性疾病临床项目达到一个关键里程碑。

肌炎
今年2月,在一项公布的新研究中,来自德国埃尔朗根大学附属医院的研究人员在世界上首次使用CAR-T细胞成功治疗一名患有抗合成酶抗体综合征,即严重肌肉炎症(肌炎)的患者(S先生)。这种疾病由免疫系统故障引发,会导致肌肉炎症,而且发展为严重的疾病的风险很高。相关研究结果于2023年2月15日在线发表在Lancet期刊上,论文标题为“CD19-targeted CAR T cells in refractory antisynthetase syndrome”。

Lancet期刊
在接受CAR-T细胞输注后,S先生的健康状况有了极大的改善:肌肉、肺部和关节的炎症几乎完全消失了,力量、表现和耐力都恢复了。论文第一作者Fabian Müller 博士说,“特别令人惊讶的是,S先生能够停止服用所有的免疫抑制药物,特别是皮质类固醇,而且这种疾病却没有再次复发。在接受CAR-T细胞治疗的六个月后,S先生已从这种自身免疫性疾病中完全康复了,而且无需使用免疫抑制药物。”
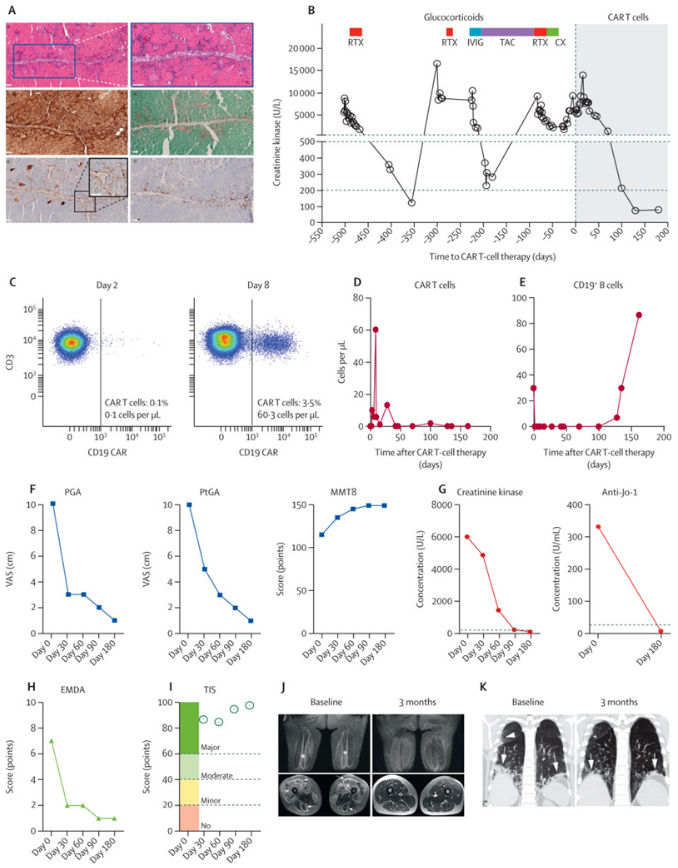
CAR-T细胞对抗合成酶抗体综合征表现的影响 图片来源:[5]
这是埃尔朗根大学附属医院德国免疫治疗中心的医生和研究人员使用CAR-T细胞成功治疗的第二种类型的自身免疫性疾病。在此之前,CAR-T细胞在治疗系统性红斑狼疮(SLE)方面表现出色。
2023年5月18日,Cabaletta Bio细胞治疗公司针对CABA-201的第二个新药申请(IND)已被美国食品药品监督管理局(FDA)批准进行1/2期病人临床研究,该疗法是一种4-1BB含有的完全人源CD19-CAR T细胞研究性疗法,用于治疗活动性特发性炎症性肌病(IIM,或肌炎)患者。而刚在一个月前,FDA还批准了活动性狼疮肾炎(LN)或无肾脏受累的活动性系统性红斑狼疮(SLE)适应症。该公司计划启动针对6名皮肌炎(DM)患者、6名抗合成酶综合征(ASyS)患者和6名免疫介导性坏死性肌病(IMNM)患者的CABA-201 1/2期临床试验,并进行单独的平行队列。不难看出,CABA-201代表了一个潜在解决各种自身免疫性疾病的机会,包括系统性红斑狼疮(SLE)、类风湿性关节炎、肌炎和系统性硬化症等。

Cabaletta的第二个CAART候选药物MuSK-CAART旨在治疗重症肌无力(MG),这是一种影响神经肌肉接头的自身免疫性疾病,可导致运动障碍、肌肉无力和呼吸衰竭。

Cabaletta在研管线 图片来源:Cabaletta官网
寻常型天疱疮
abaletta Bio中进展较快的管线是DSG3-CAART,已进入临床1期,用于治疗患有黏膜型寻常型天疱疮(mPV)的患者,这是一种自身免疫性疾病,由针对角质形成细胞粘附蛋白Dsg3的自身抗体引起。DSG3-CAART旨在选择性靶向并杀死产生DSG3抗体的B细胞,同时保留对免疫功能至关重要的健康B细胞。
PLA2R相关性膜性肾病(MN)
Cabaletta 旗下的PLA2R-CAART正被开发用于治疗PLA2R相关性膜性肾病(MN)患者。B细胞介导的自身免疫性疾病会影响肾脏。B细胞产生自身抗体,其被认为形成沉积在肾小球基底膜上的免疫复合物,引起过滤屏障的破坏,并导致蛋白尿。随着时间的推移,PLA2R相关的MN可能导致肾衰竭和终末期肾病。
视神经脊髓炎谱系疾病
去年8月,伊基仑赛(CT103A)注射液针对视神经脊髓炎谱系疾病(NMOSD)的临床试验申请IND在中国获批,这也是全球第一个针对NMOSD的CAR-T细胞疗法,由信达生物与驯鹿生物共同开发,靶向BCMA。研究结果显示伊基仑赛注射液在治疗传统疗法控制不佳的NMOSD受试者具有较为可靠的安全性,所有的CRS均为1-2级,未观察到任何ICANS。有效性方面,50%受试者视力改善,67%受试者行走能力改善,75%受试者直肠膀胱功能改善。

结语
在近些年生物技术的不断发展中,企业已不再只扎堆于CAR-T治疗肿瘤,而不断朝着自免疾病领域方向迈进。从目前来看,在CAR-T在治疗自身免疫性疾病中, 系统性红斑狼疮是一个最热门的方向。但许多企业,正如Kyverna一样,朝着更广阔的自免适应症方向拓展,硬皮病、肾炎、干燥综合征、视神经脊髓炎谱系障碍、抗合成酶抗体综合征等研究正在紧罗密布地开展中,谁将最先能填补上市CAR-T治疗自免疾病的空缺,让我们翘首以盼。