图源:britannica.com
撰文丨王笑涵
审核丨喻柏雅
罕见病不仅罕见,治疗手段也十分局限,目前全球只有不到5%的罕见病有药可医,罕见病用药被形象地称为“孤儿药”。除了药物治疗,近年来一些新兴治疗方法备受关注并被寄予厚望,其中以干细胞治疗为代表的再生医学,被誉为是继药物治疗、手术治疗后的第三次医疗革命,已然成为罕见病领域研究的新焦点,越来越多的突破性研究成果为罕见病治疗带来新思路,越来越多的成功案例为罕见病患者带来福音,为他们点燃治愈的希望。
一、干细胞的定义
干细胞的英语名称是“stem cell”,“stem”意为树干和起源。就如一棵树干可以长出枝叶并开花、结果一样,干细胞可以进行自我复制,同时在一定条件下可以分化成为各种不同的组织细胞,是形成人体各组织和器官的起源细胞。
干细胞具有自我更新、多向分化两大基本特性,在人体组织和器官的修复与再生中发挥着重要作用。此外,干细胞的归巢性使其可以精准定位到损伤器官。由此应运而生的干细胞治疗,指利用干细胞或干细胞衍生的细胞,以特殊技术移植到体内,替代或分泌活性因子修复受损的细胞、组织或器官。
二、干细胞的分类
按照分化潜能,干细胞可以分为全能干细胞、多能干细胞与专能干细胞。
全能干细胞分化潜能最高,可以分化成所有的组织和器官,且可以发育、成为完整的生命个体。对于人体,只有处于受精卵到囊胚时期的细胞才属于全能干细胞。
多能干细胞的分化潜能次之,它们可以分化为成年机体中的多种细胞组织,但不能分化为胎盘、脐带等附属支持组织,也就没有发育成完整个体的能力。
专能干细胞的分化潜能更加有限,它们只能定向分化为组织或器官中某一类型的细胞,但它们具有自我更新属性,因此可以与非干细胞相区分。
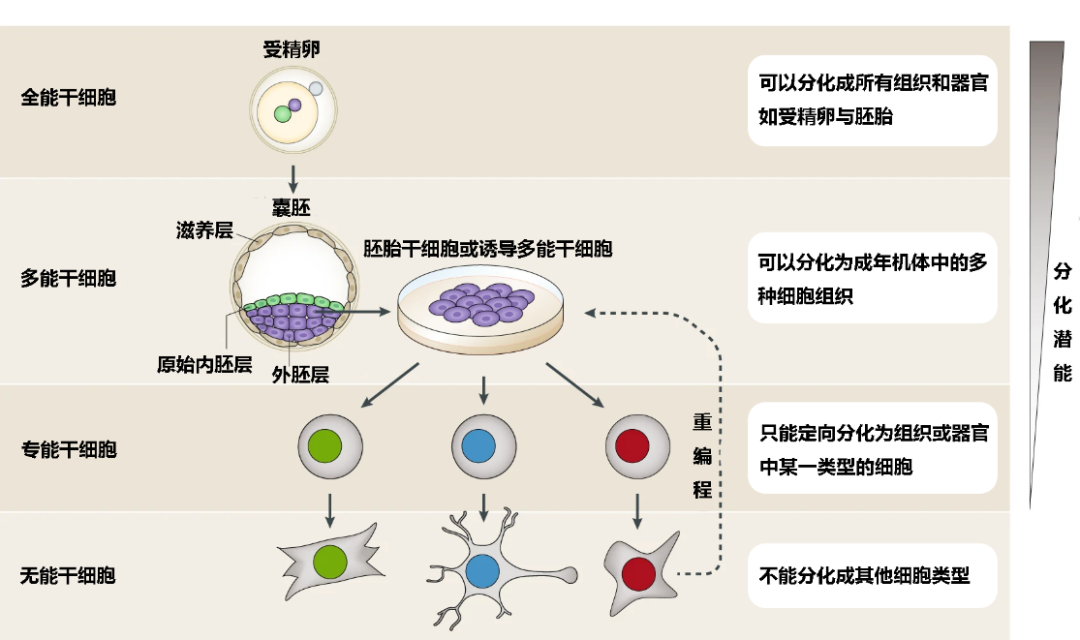
▲图1:干细胞的层级结构 (图片作者:Mukul Tewary et al.;翻译:王笑涵)
三、干细胞治疗的方式
不同种类的干细胞对应的治疗原理自然不同,主要包括以下三个方面:
1 体内分化,体内治疗 在体外进行简单的分离之后,干细胞可以直接移植进入人体内修复损伤部位。其中,最具代表性及发展前景的是造血干细胞移植治疗,可以用于治疗血液系统疾病、免疫缺陷病、遗传代谢病等,甚至是某些疾病的唯一治愈手段。 造血干细胞主要存储于骨髓、外周血及脐带血中。造血干细胞移植就是将自己或他人的健康造血干细胞移植到体内,这些干细胞可以重建造血功能、维持机体免疫系统稳态,具有分化形成各种血细胞亚型和免疫细胞的潜能,从而达到治疗效果。 按照采集造血干细胞的来源不同,造血干细胞移植可以分为骨髓移植、脐带血移植、外周血造血干细胞移植等;按照供体与受体的关系,又可以分为自体移植与异体(异基因)移植,而当供者为同卵双生时,称为同基因移植。
2 体外分化,替代治疗 在特定条件下,干细胞可以在体外被大量扩增并诱导分化为特定的功能细胞,再移植入人体内,修复损伤部位,治疗特定疾病。其中,最具代表性的是多能干细胞治疗,如胚胎干细胞与诱导多能干细胞。此外,该原理还被应用于诸多干细胞衍生技术,如类器官技术、3D细胞打印技术等。
3 分泌效应,药用信号 大部分干细胞进入体内后,并不会直接分化为损伤部位的细胞,而是通过分泌活性因子促进组织的修复再生。其中,最具代表性的是间充质干细胞(mesenchymal stem cells, MSC)治疗。 MSC具有强大的分泌功能,能够表达、合成和分泌各类生长因子、细胞因子、调节因子、信号肽等生物活性分子,发挥免疫调控、抗细胞凋亡、促进血管生成、支持干细胞生长分化等功能,在组织修复过程中起着重要作用。此外,相比其他种类的干细胞,MSC具有来源广泛、制备相对容易、免疫原性低等优点,因此已被广泛应用于临床研究及实践,如自身免疫性疾病、神经系统疾病、骨关节病等。
▲图2:MSC可以从各种胎儿、新生儿和成人组织中分离出来,并分化成不同的细胞类型 (图片作者:樊星亮等 ;翻译:王笑涵)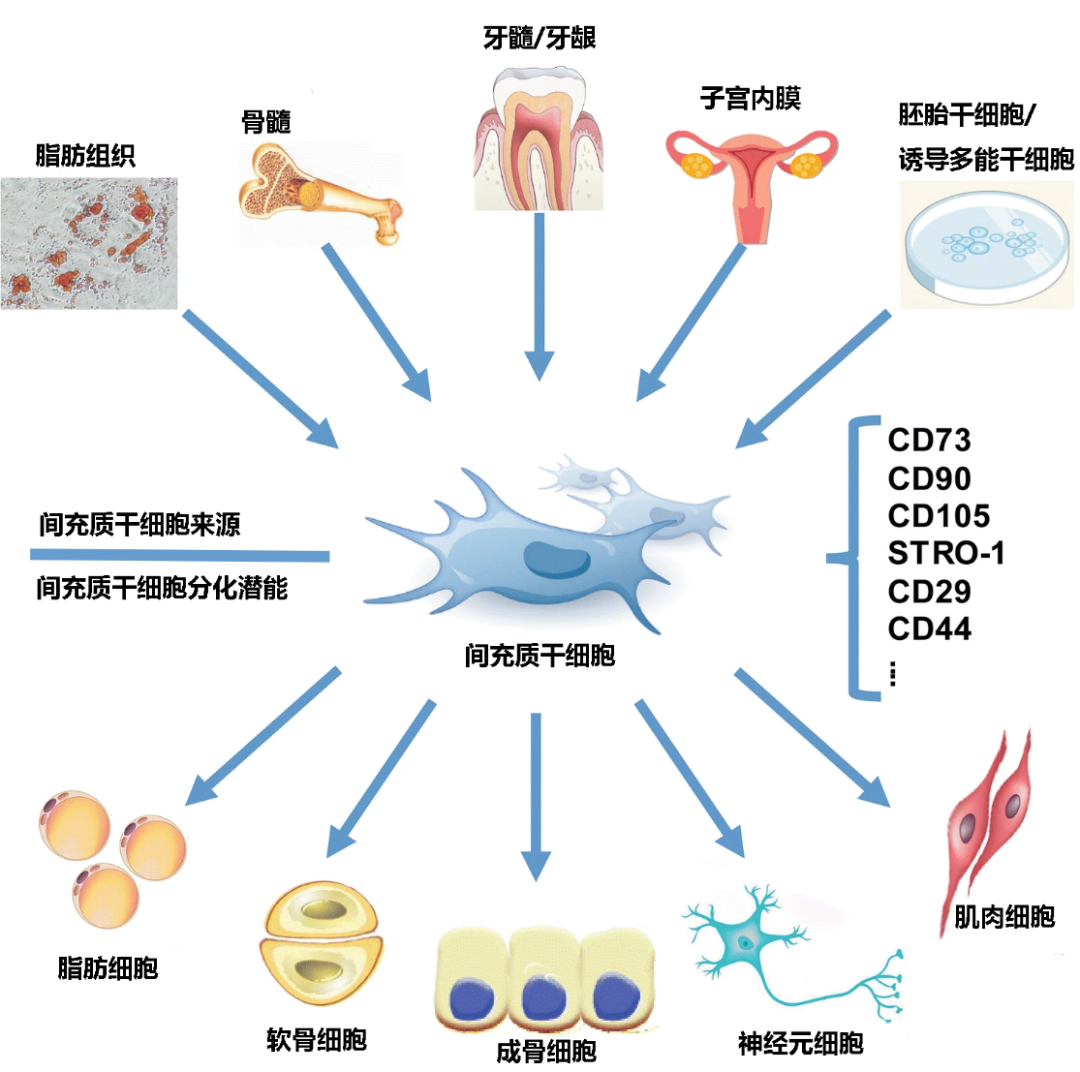
值得一提的是,在上述干细胞治疗方法中,胚胎干细胞、诱导多能干细胞的应用在很大程度上受到了伦理、法律和政策等方面的限制,因此,当前研究多围绕MSC、造血干细胞、器官特异性干细胞(如神经干细胞、脂肪干细胞)等展开。
四、干细胞治疗在罕见病领域的应用
正如中国工程院院士陈香美在2018年上海市罕见病/孤儿药学术年会上所说:“未来最有效的干细胞疗法可能是在罕见病上。”近年来,干细胞治疗在罕见病领域已取得了一些喜人的结果,有望打破罕见病患者“病无所医,医无所药”的窘境。
在缺乏有效治疗药物或根治手段的背景下,自体干细胞移植(尤其是造血干细胞移植)成为许多罕见病唯一的治愈手段,为罕见病患者带来了新的曙光。如范尼可贫血、戈谢病、Castleman病、赖氨酸尿蛋白不耐受症、线粒体脑肌病、黏多糖贮积症、多发性硬化、POEMS综合征、卟啉病、原发性联合免疫缺陷、原发性轻链型淀粉样变、进行性肌营养不良、重症先天性粒细胞缺乏症、系统性硬化症、湿疹血小板减少伴免疫缺陷综合征、X-连锁无丙种球蛋白血症、X-连锁淋巴增生症等均有成功治愈的病例报道或相关基础及临床研究展开。
间充质干细胞治疗在罕见病领域也得到了很好的发展,为罕见病提供了新的治疗策略,如肌萎缩侧索硬化、黏多糖贮积症、全身型重症肌无力成骨不全症、脊髓性肌萎缩、脊髓小脑性共济失调、遗传性大疱性表皮松解症、特发性肺纤维化、系统性硬化症等。
此外,随着分子生物学技术,尤其是基因编辑技术的不断发展,基因修饰在干细胞治疗中也发挥着越来越重要的作用。在罕见病领域,浙江大学遗传学研究所管敏鑫团队基于CRISPR/Cas9基因编辑技术和诱导多能干细胞技术,成功实现了Leber遗传性视神经病变(Leber’s hereditary optic neuropathy, LHON)患者视网膜神经节细胞形态和功能的重塑,为LHON的治疗带来新的曙光;Nula-cel是一款基于基因编辑的自体干细胞基因疗法,可以直接纠正镰刀型细胞贫血病的基因突变,目前已获得FDA孤儿药资格认证,但遗憾的是由于第一位服用Nula-cel的患者发生严重不良事件,已于2022年底暂停了I/II期开放标签、单剂量临床试验。
类器官是指利用成体干细胞或多能干细胞进行体外三维培养而形成的具有一定空间结构的组织类似物,是干细胞研究中令人振奋的进展之一,在罕见病领域也得到了一定的发展。加拿大渥太华医院Adam Pietrobon研究团队从人类干细胞培养出3D肾脏类器官,为结节性硬化症的肾脏病变发病机制提供了见解。
五、几种罕见病的干细胞疗法进展
由于肌萎缩侧索硬化、多发性硬化、成骨不全症等罕见病的干细胞治疗研究得到了充分发展,在此做简要介绍。
1
肌萎缩侧索硬化
Amyotrophic lateral sclerosis, ALS
ALS是一种以上、下运动神经元损伤为特征的神经退行性疾病。2000年,美国Gearhart和Kerr教授等首次将胚胎干细胞植入ALS模型小鼠的脑脊液中,实验结果显示小鼠运动功能明显恢复,且6%的干细胞迁移入脊髓内部并表达神经细胞特异的表面标记,提示干细胞已分化为神经元样细胞,开启了干细胞治疗ALS的新时代。
NSI-566是一种人脊髓源性神经干细胞系,于2010年获得FDA批准,开启了首个干细胞治疗ALS的临床试验;在已完成的II期ALS试验中显示出良好的安全性和耐受性,并于2020年进入III期临床试验。AstroRx是一款是从多能干细胞分化而成的人类星形胶质细胞,于2018年获得FDA孤儿药认定,并于2020年完成了I/IIa期临床试验。 NurOwn是一款自体干细胞疗法,源于患者自身骨髓的MSC,已获得了美国FDA和欧盟EMA授予的孤儿药认定。遗憾的是,NurOwn在治疗ALS的III期临床试验中显示未能达到主要终点指标和关键次要终点。好在I、II期临床研究表明,NurOwn给药是安全且耐受性良好的,且在病情较轻的患者组中产生了具有临床意义的作用。NeuroNata-R也是一种MSC疗法,已于2014年被韩国食品药品安全部批注用于治疗ALS,并于2021年在韩国完成III期临床注册。 2 多发性硬化 Multiple sclerosis, MS MS是一种以中枢神经系统白质炎性脱髓鞘病变为主要特点的自身免疫病。NG-01细胞疗法,指首先从患者身上采集骨髓,从骨髓中分离特定的干细胞并增强其活性,然后将这些细胞注射回患者的中枢神经系统,2006年开展的I/II期临床试验初步证实了其安全性,并在之后的II期临床试验中证实了有效性,还可以控制病情恶化。2018年3月公布的一项III期临床试验结果显示,自体造血干细胞移植可显著改善复发缓解型MS患者的运动障碍。2019年美国启动了NurOwn治疗进展性MS的II期临床试验,证实了其良好的安全性及有效性。 3 成骨不全症 Osteogenesis imperfecta, OI OI是一种先天性骨骼发育障碍疾病。研究发现,将骨髓间质干细胞和I型胶原混合后,注射至OI模型小鼠股骨的骨髓腔中,骨髓间质干细胞可分化成为成骨细胞和骨细胞,并在体内合成高密度新骨,显著改善了小鼠长骨的强度。间充质干细胞治疗OI安全性较好,治疗和随访期间,患者骨折减少,骨矿化增加,骨微结构改善,但OI患者自身的MSCs成骨潜能较低且矿化能力受损,直接用于干细胞治疗的疗效有限。为克服这一问题,Le Blanc等人使用了来自胎儿肝脏的间充质干细胞(FL-MSCs),病例报告显示了良好的疗效。目前,有两项正在进行的多中心临床研究评估HLA不匹配的FL-MSCs治疗。 令人欣喜的是,已有干细胞疗法上市。2012年美国FDA批准了Athersys公司研发的间充质干细胞疗法MutiStem®上市用于治疗I型黏多糖贮积症。此外,当前在研的一些干细胞疗法的适应症正在往罕见病领域延伸,如2016年在日本上市的针对移植物抗宿主病的骨髓间充质干细胞产品Temcell,已被拓展至遗传性大疱性表皮松解症的治疗研究之中。 干细胞治疗在罕见病领域的应用同时面临前景与挑战,细胞质量、注射途径、最佳剂量、治疗时机等问题有待进一步探索。相信随着干细胞技术的不断发展以及临床转化研究的不断深入,越来越多曾经无计可施的罕见病将拥有治疗,甚至治愈的机会,为罕见病患者点燃了治愈的希望! 本文转载自:瑞鸥公益基金会