5月4日,诺和诺德在2023Q1财报中透露,已于4月24日收到FDA就concizumab用于预防治疗伴抑制物的A型和B型血友病的生物制品许可申请(BLA)发出的完整回复函(CRL)。

诺和诺德表示,FDA要求其提供额外的与患者相关的监测和给药信息,以确保concizumab按预定方案给药。此外,诺和诺德还需要提交额外的concizumab生产过程材料文件。
concizumab是一款靶向组织因子途径抑制物(TFPI)的人源IgG4单克隆抗体。TFPI是控制凝血启动阶段的一种抗凝蛋白,通过抑制凝血因子VIIa-组织因子-凝血因子Xa(FVIIa-TF-FXa)复合物的生成削弱外源性凝血途径。concizumab通过双重机制发挥促凝血作用:①高亲和力竞争性结合TFPI的Kunitz型蛋白酶抑制剂2(KPI-2)结构域,阻止TFPI与FXa的结合;②阻止TFPI对TF-FVIIa复合物的抑制。
2022年8月,诺和诺德基于III期Explorer7研究的积极数据向FDA递交concizumab的BLA。该研究是一项随机、开放标签临床试验,共纳入133例患者,旨在评估concizumab(每日1次,皮下注射)在伴有抑制物的A型和B型血友病患者中预防出血的有效性和安全性。
患者将按1:2分为两个队列:①concizumab预防治疗组(研究启动时即开始接受治疗)和②concizumab非预防治疗组(研究启动6个月后开始接受治疗)。研究的主要终点为治疗自发性和创伤性出血事件的发生次数(年出血率,ABR)。

concizumab预防治疗组的给药方案
结果显示,相比于未接受concizumab预防治疗的患者,接受concizumab预防治疗患者的治疗自发性和创伤性出血事件减少了86%(平均ABR1.7 vs 11.8)。此外,预防治疗组63.6%的患者未发生治疗性出血事件,而非预防治疗组这一比例为10.5%。
安全性方面,未见报告治疗重新开始时发生血栓栓塞事件。
目前,全球共39款血友病药物获批上市,其中仅Hemgenix(CSL)、Roctavian(BioMarin)和Hemlibra(罗氏)为非凝血因子类药物。接受凝血因子类药物治疗的血友病患者体内可能会产生凝血因子抑制物,导致其疗效大打折扣,并且可能还会导致严重的过敏反应。据统计,30%的A型血友病患者和1%-3%的B型血友病患者会产生抑制物。
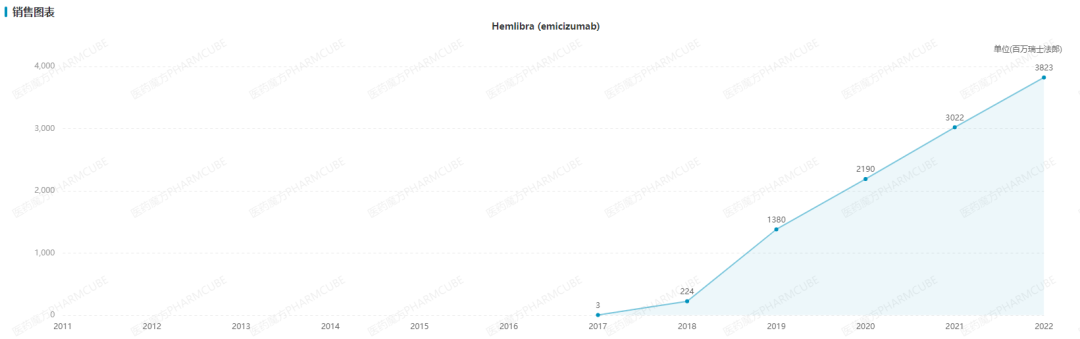
Hemlibra(艾美赛珠单抗)是一款FIXa/FX双抗。作为血友病领域第一款非凝血因子类药物,Hemlibra(艾美赛珠单抗)自2017年上市以来即迅速放量占领市场,2022年Hemlibra销售额已达到38.23亿瑞士法郎(约40亿美元)。
诺和诺德亦开发了一款FIXa/FX双抗NNC0365-3769,其凝血活性约为Hemlibra的15倍。
辉瑞是诺和诺德在血友病领域的另一强大竞争对手,手握3款III期在研非凝血因子类药物,包括两款基因疗法(fidanacogene elaparvovec和giroctocogene fitelparvovec)和一款TFPI单抗(marstacimab)。