
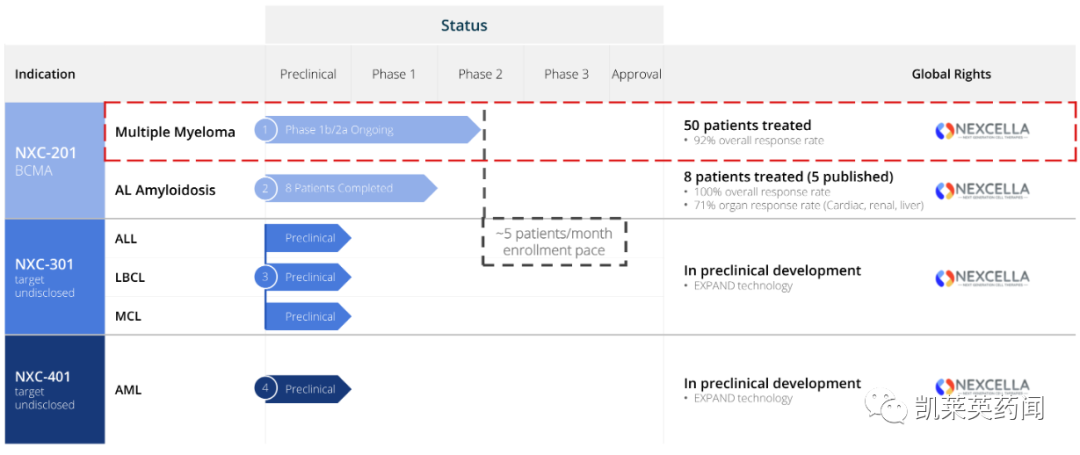
2023 年 4 月 26 日,Nexcella宣布,子公司Immix Biopharma(“ImmixBio”)用于治疗复发或难治性轻链型(AL)淀粉样变性和多发性骨髓瘤患者的细胞疗法 NXC-201 ,在正在进行的1b/2期NEXICART-1 (NCT04720313) 试验中获得新的积极临床数据。这些数据于4月23日至26日,在法国巴黎举行的第49届欧洲血液和骨髓移植学会年会上展示。
|关于NEXICART-1
NEXICART-1是一项正在进行的1b/2期开放标签研究,评估NXC-201在成人复发或难治性多发性骨髓瘤和AL淀粉样变性中的安全性和有效性。该研究的 1b 期部分是验证药物的安全性,并确认 NXC-201 的最大耐受剂量( MTD )和 2 期剂量;2期部分将以总生存期、无进展生存期和反应率为终点,评估NXC-201的疗效和安全性。
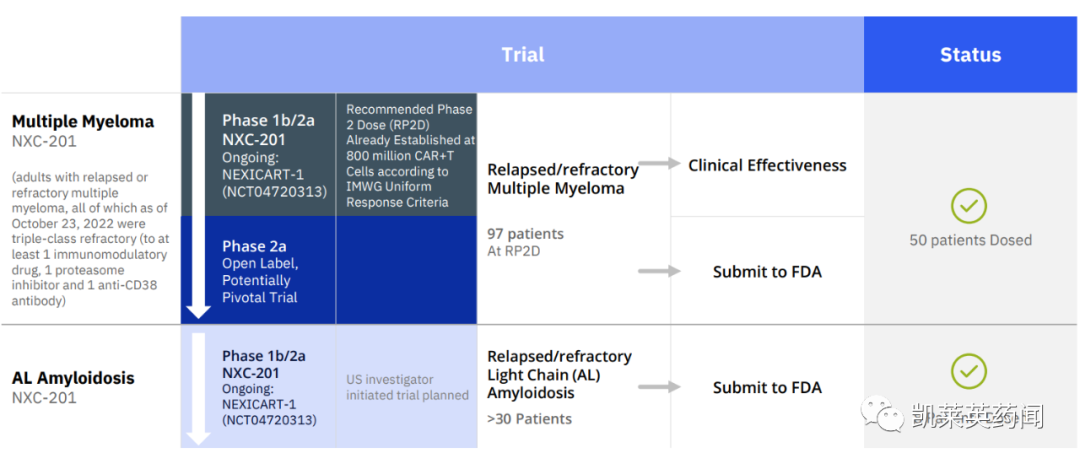
截至 2023 年 2 月 9 日,共有 50 名患者接受规定剂量的NXC-201,中位随访时间为 5.7 个月,数据显示:
在多发性骨髓瘤患者中,主要终点是总体缓解率和缓解持续时间:
总反应率是92%,中位无进展生存期 (mPFS) 为 12.3 个月。
观察到 87% 的总体反应率(包括既往接受过和未接受过 BCMA 靶向治疗的患者)。
57% 的完全缓解率(包括既往接受过和未接受过 BCMA 靶向治疗的患者)。
Nexcella 计划在 100 名患者接受 NXC-201 治疗后,向FDA提交BLA。
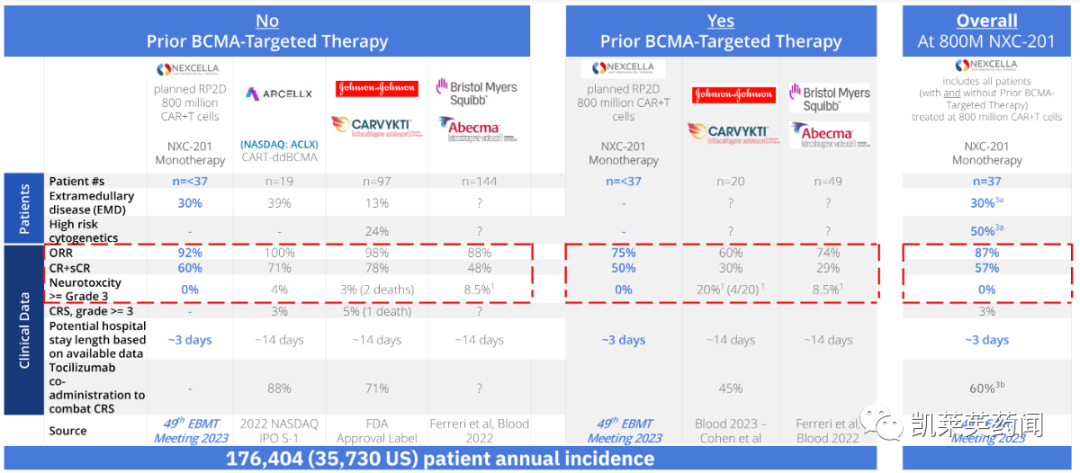
细胞因子释放综合征 (CRS) 中位发作第 0 天;中位CRS 持续时间 1 天;无4 级 CRS;在 42 名复发/难治性多发性骨髓瘤患者中只有 1 例 3 级 CRS。
在AL淀粉样变性患者中,主要终点是总反应率:
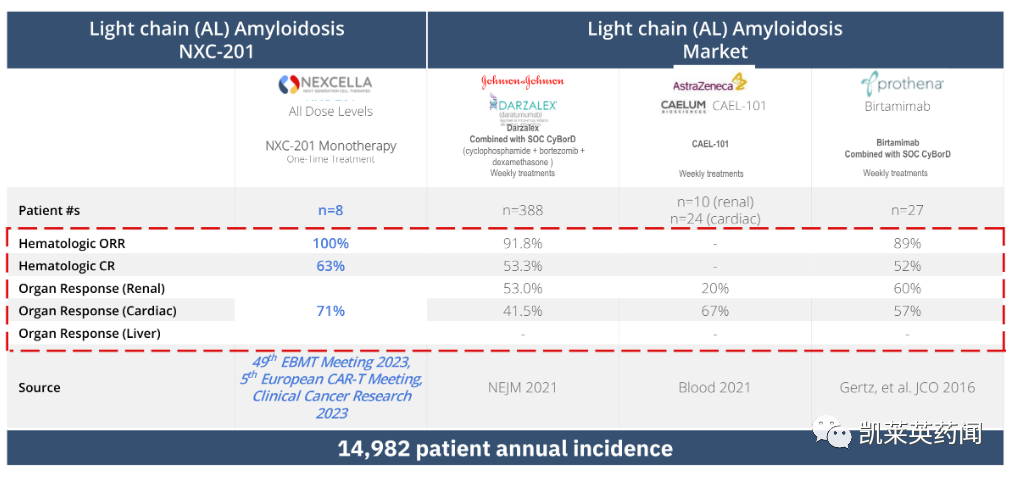
在 8 名轻链 (AL) 淀粉样变性患者中,产生的总反应率为 100% (8/8);器官反应率为 71%(心脏、肾脏、肝脏),血液学反应率为 63%。
Nexcella 计划在Nexcella 计划在30-40 名患者接受 NXC-201 治疗后,向FDA提交BLA。
|关于NXC-201
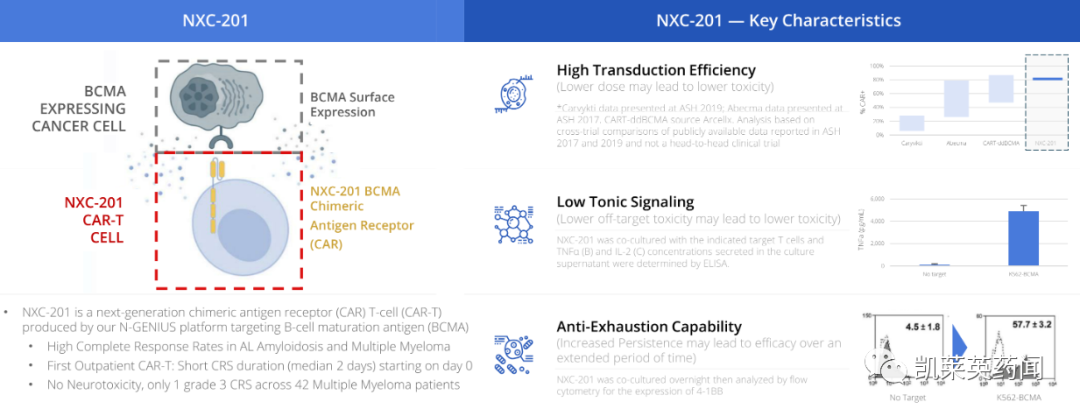
NXC-201(HBI0101)是一种在研的靶向 BCMA嵌合抗原受体 T (CAR-T) 细胞疗法。NXC-201包含公司专有BCMA靶向CAR结构,该CAR已被证明可降低免疫疗法的毒性,支持患者在门诊中使用。
其中,多发性骨髓瘤(MM)是一种无法治愈的浆细胞血癌,始于骨髓,其特征是细胞过度增殖,对标准疗法(包括蛋白酶抑制剂和免疫调节剂)治疗无反应或复发的患者的预后仍然很差。根据Nature Reviews报道,2017 年多发性骨髓瘤市场价值 139 亿美元,预计到 2027 年将达到 287 亿美元。

AL淀粉样变性是一种罕见的系统性疾病,由骨髓浆细胞异常引起。浆细胞产生的折叠异常的淀粉样蛋白会在组织、神经和器官中及其周围积聚,最终导致器官功能衰竭及死亡。据统计,AL淀粉样变性全球发病率约为15000人/年。根据 Grand View Research 的数据,2017 年淀粉样变性市场规模为 36 亿美元,预计到 2025 年将达到 60 亿美元。

据统计,NXC-201是目前唯一在AL淀粉样变性领域在研的CAR-T疗法,有望在上述两种治疗领域实现突破!
|关于BCMA CAR-T
CAR-T疗法目前被认为是治疗复发难治性多发性骨髓瘤(RRMM) 最有效的手段之一,其利用T 细胞嵌合胞外区的T 细胞受体,靶向结合肿瘤抗原并激活胞内信号,从而靶向杀伤肿瘤细胞。目前已获批或正在进行临床研究中治疗MM 的CAR-T涉及靶点主要包括BCMA 、CD19、信号淋巴细胞激活分子家族成员7( SLAMF7,又名CS1) 、κ 轻链、CD38、CD138、NKG2D、CD56、CD44v6和G 蛋白偶联受体家族C 组5 成员D。
BCMA 特异性表达于B 细胞谱系,主要是成熟B 细胞到浆细胞分化的终末阶段,并广泛表达于骨髓瘤细胞,使得BCMA 成为理想的治疗靶标。相较于CD19 靶点,BCMA治疗具有有效性更高,副反应更低的优点。
II期以上阶段的靶向BCMA CAR-T
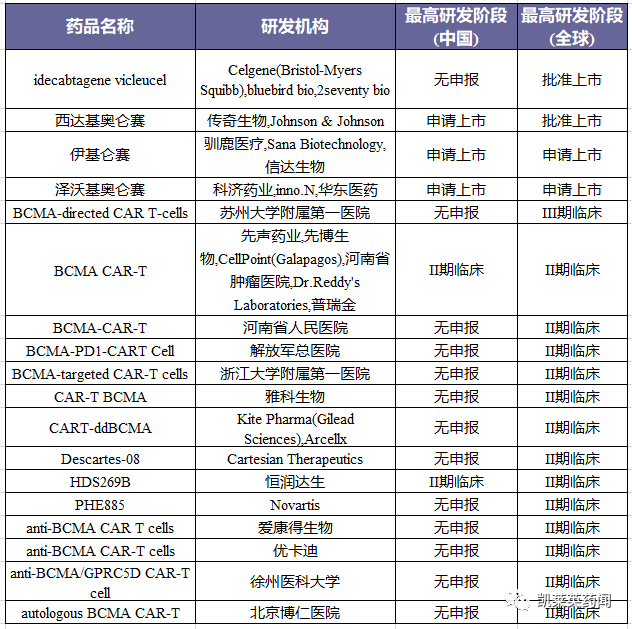
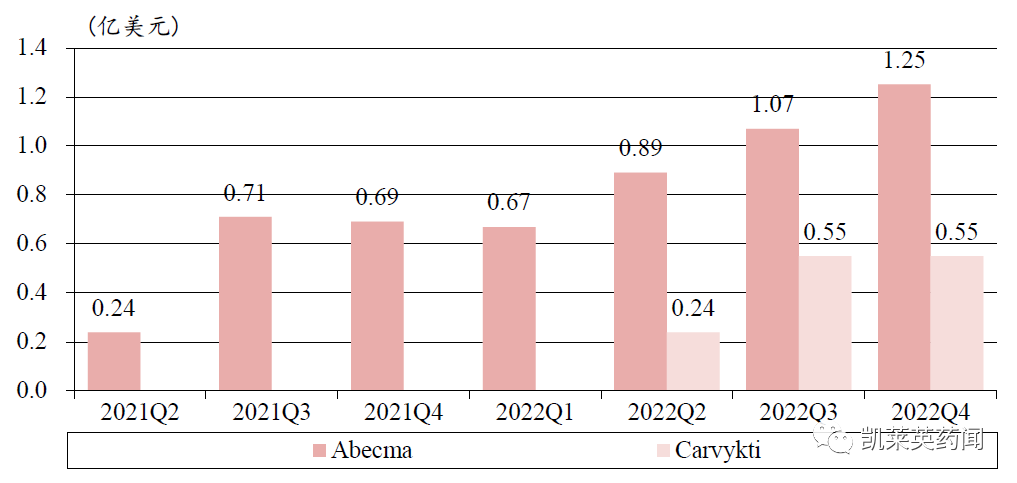
据不完全统计,目前在研的BCMA CAR-T约百余种,Abecma 是全球首款上市的BCMA CAR-T 疗法,用于治疗多发性骨髓瘤,上市首年销售额为1.64亿美元,2022 年销售额为3.88 亿美元,同比增长136%,有望成为BMS 下一个重磅产品。传奇生物的CAR-T 疗法Carvykti 是全球第2 款获批的BCMA CAR-T,在上市首年累计实现销售额1.34亿美元。
BMS Abecma 和传奇生物Carvykti 2021,2022 年各季度销售额
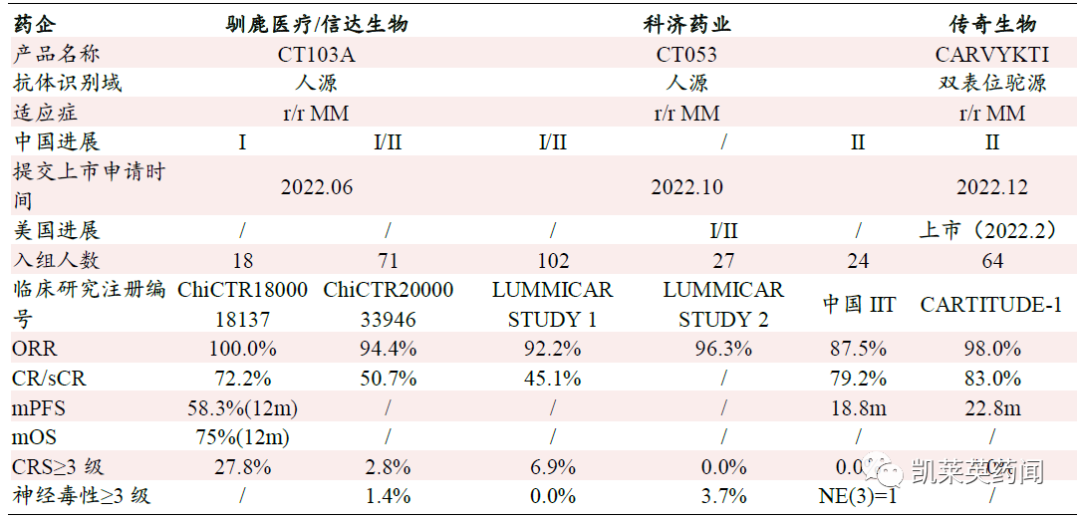
纵观国内,目前已经有3 款BCMA CAR-T 产品提交上市,从初步数据来看,3款产品的ORR 均能达到90%左右水平,整体展现出优于CD19 靶点CAR-T 治疗的有效性和安全性。
CT103A:商品名为伊基仑赛注射液,是由驯鹿医疗研发的一款BCMA CAR-T 细胞疗法,2022 年6月新药上市申请获得药监局受理。以慢病毒为基因载体转染自体T细胞,CAR 包含全人源scFv、CD8a 铰链和跨膜、4-1BB 共刺激和CD3ζ 激活结构域。根据驯鹿医疗在美国血液学会《Blood》杂志披露的早期临床数据,入组的18 例受试者的ORR 为100%,完全缓解率为72.2%。副作用方面,94%的受试者出现不同程度副作用,其中≥3 级的细胞因子释放综合征的发生率为28%;排除最高剂量组6X106/kg,≥3 级细胞因子释放综合征的发生率为13%。临床策略方面,伊基仑赛优先国内市场。
目前,伊基仑赛的上市申请获药监局受理。
CT053:商品名为泽沃基奥仑赛注射液。是科济药业研发的一款BCMA CAR-T 细胞疗法,2022 年10 月18 日,新药上市申请获得药监局受理。CT053 结构是基于慢病毒载体的BCMA 靶向CAR-T细胞结构,包含一个完全人源单链抗体、CD8α 铰链以及跨膜区、4-1BB 共刺激和CD3ζ 激活域,由科济药业开发。目前在美国和欧洲均有相应的临床开展,用于治疗RRMM。此次泽沃基奥仑赛申请受理,是基于一项在国内进行的名为LUMMICAR STUDY 1 的开放、单臂I/II 期临床试验。截至2022 年8 月16 日,102 例患者的中位随访时间为9 个月,客观缓解率为92.2%,完全缓解率为45.1%。安全性方面,102 例患者均报告了治疗相关的不良事件(AEs),AEs 主要包括与清淋相关的血液学毒性,其中7 例(6.9%)发生了3/4 级细胞因子释放综合征。
Carvykti:是由传奇生物开发的西达基奥仑赛注射液,2022 年12 月30 日,上市申请获药监局受理,用于治疗复发/难治性多发性骨髓瘤患者。这是美国FDA 批准上市后,又继续申请国内上市的CAR-T产品。西达基奥仑赛是目前全球范围内上市的8 款CAR-T 产品中,唯一一款基于纳米抗体的CAR结构产品,纳米抗体作为CAR 靶向域具有低免疫原性、高有效性、不会引起T 细胞耗竭和强而快的组织穿透力等优势。
国内BCMA-CAR-T 产品临床数据及上市情况
|关于Nexcella
Nexcella是Immix拥有98%股权的子公司,是一家临床阶段的生物制药公司,致力于发现和开发用于肿瘤学和其他适应症的新型细胞疗法。公司利用N-GENIUS平台,开发和制造尖端的细胞疗法。
|关于Immix
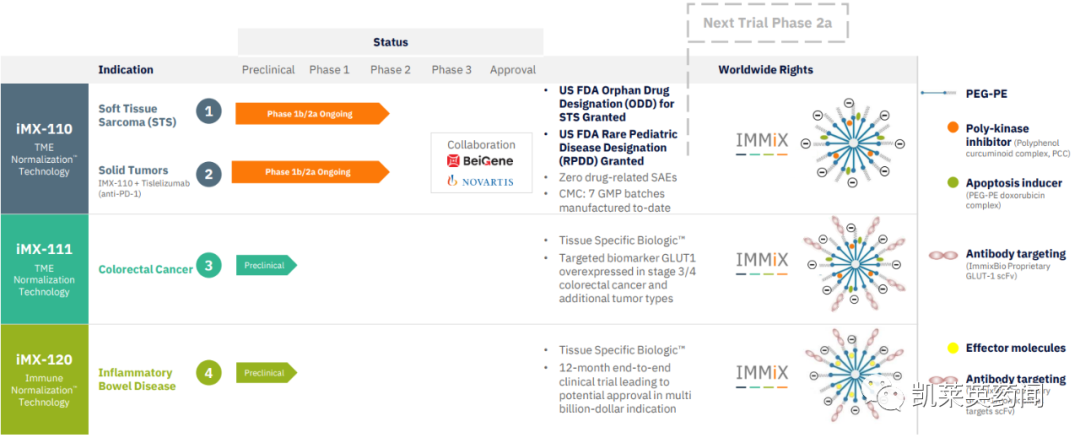
Immix 是一家处于临床阶段的生物制药公司,开创了一类新型组织特异性疗法(TSTx),用于肿瘤学和免疫失调疾病。公司重点药物IMX-110正作为单一疗法进行1b/2a期临床试验,并与百济神州/诺华的抗PD-01替雷利珠单抗联用进行IMMINENT-1临床试验。此外,IMX-110被FDA授予针对软组织肉瘤的孤儿药指定(ODD),并获得 FDA 的罕见儿科疾病指定(RPDD),用于治疗横纹肌肉瘤。
参考资料
1、公司官网
2、中银国际