
3月16日,Sarepta Therapeutics宣布,在其SRP-9001 生物制剂许可证申请(BLA)的周期后期会议上,美国食品和药物管理局治疗学办公室(OTP)已确定,在2023年5月29日监管行动日期之前,将举行SRP-9001咨询委员会会议。SRP-9001是Sarepta用于治疗杜氏肌营养不良(DMD)的研究性基因疗法。

两周前,Sarepta表示,公司已经完成了SRP-9001提交的中期审查,由于没有出现重大的安全性或临床问题,FDA将在没有咨询委员会会议的情况下评估其SRP-9001。FDA的这一决定使Sarepta股价大涨,并且SRP-9001有望在5月29日之前获得批准,而无需面对独立专家的审查。
由于FDA突然改变主意,将召集专家深入研究SRP-9001的有关数据。这一消息导致Sarepta 股价下跌18%,跌至每股122美元。目前市值108亿美元。
Sarepta总裁兼首席执行官Doug Ingram表示,公司没有提供新的数据,因此上述变动似乎不是由数据驱动的。

Ingram说:“作为第一批建立在替代终点上的基因治疗生物制剂许可证申请(BLA)之一,咨询委员会会议将主要涉及支持SRP-9001抗肌营养不良蛋白有合理可能预测临床获益这一结论的全部证据,这是加速批准的标准。其实从2022年秋季申请BLA开始,我们就一直在筹备咨询委员会会议。我们将做好充分的准备,并期待展示支持SRP-9001变革潜力的丰富证据。”
Sarepta预计FDA将在下周内确定咨询委员会会议的日期,并再次与FDA进行了核实,FDA表示没有设立咨询委员会的计划。
瑞穗分析师表示,这一“出人意料的转机”并未改变他们对加速批准SRP-9001的可能性的看法。鉴于AdCom的通知比预期晚,投资者可能会担心批准延迟,但FDA的公开声明可能会让投资者放心,SRP-9001会在5月29日左右如期获得批准。
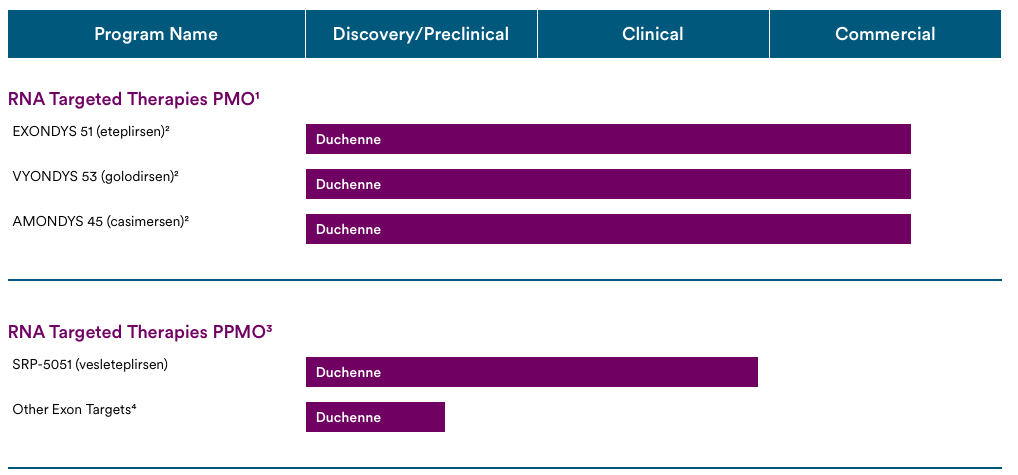
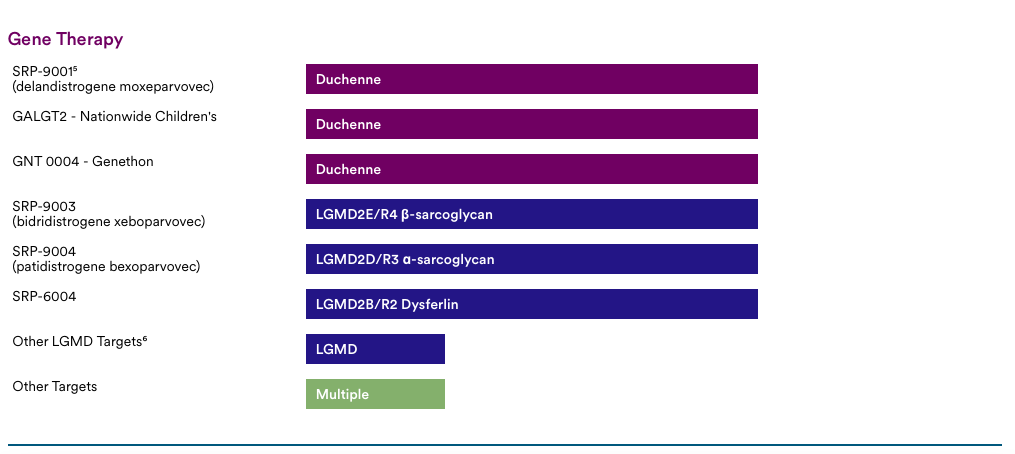
Sarepta Therapeutics专注于杜氏肌营养不良症(DMD)和肢带型肌营养不良症(LGMDs),目前有40多个项目处于不同的发展阶段。

参考资料:
药融云数据库
公司官网