日前,FDA官员在官网上发表文章,列举了CDER在促进罕见病新药开发方面的最新进展。文章指出,在去年5月,CDER推出了加快罕见疾病治愈(Accelerating Rare disease Cures,ARC)项目。这一项目寻求利用CDER的整体专长来驱动罕见病的科学和监管创新。在过去的1年里,ARC项目聚焦于增强与患者、倡导组织、产业界和其它利益攸关方的合作。
同时,CDER与FDA的生物制品评价和研究中心合作,启动罕见病终点进展(Rare Disease Endpoint Advancement,RDEA)试点项目。这一项目将支持创新疗效终点的开发,促进治疗罕见病的药物的及时批准。
在2022年,CDER批准创新药中54%为治疗罕见病的药物,过去10年里,治疗罕见病的获批药物占获批新药的比例也呈现上升趋势。
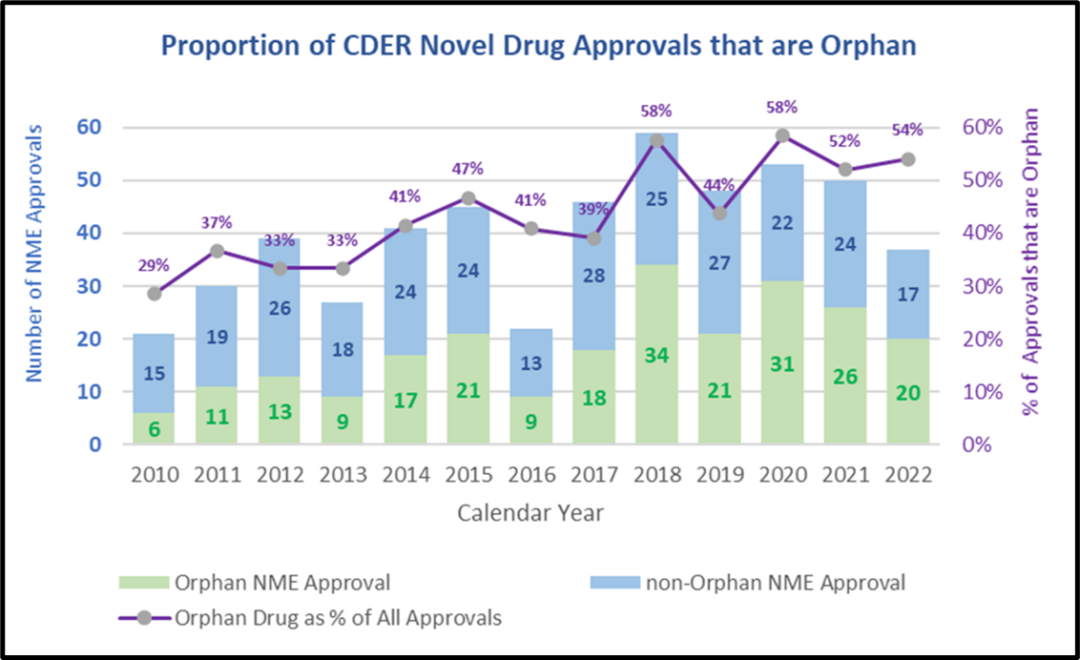
CDER批准新药中孤儿药的比例呈现上升趋势(图片来源:FDA官网)
CDER还与C-Path组织合作,在ARC项目中启动了三个新的子项目,促进针对溶酶体疾病、罕见神经退行性疾病、和α1-抗胰蛋白酶缺乏症(AATD)的新药研发。
相关链接:
https://www.fda.gov/drugs/news-events-human-drugs/cder-continues-advance-rare-disease-drug-development-new-efforts-including-accelerating-rare-disease