2023年2月23日,根据Intellia Therapeutics周四发布的2022年财务业绩,诺华(Novartis)已经放弃了使用Intellia Therapeutics的CRISPR基因编辑平台开发的体外镰状细胞病(SCD)项目。 诺华曾在2014年参与了Intellia Therapeutics的首轮融资。随即于2015年1月便与Intellia T展开了一项长达5年的研发合作计划,并在2018年12月宣布与Intellia Therapeutics扩大现有的细胞疗法项目的合作,共同开发CAR-T疗法、以及造血干细胞和眼部干细胞(OSC)疗法。 此次放弃与长期合作伙伴Intelliaa Therapeutics合作开发SCD药物的决定,可能与诺华另一项基因编辑合作有重叠。 2022年6月,诺华制药宣布与基因编辑公司Precision BioSciences签订了全球独家体内基因编辑研发合作协议,预付7500万美元,Precision BioSciences将通过其独有的ARCUS基因组编辑技术定制出一款用于一次性转化治疗血红蛋白病(如镰状细胞病和β地中海贫血症等)的核酸酶,诺华将负责该核酸酶所有后续研究、开发、制造和商业化活动的责任。如果一切顺利,Precision BioSciences可以从诺华获得高达14亿美元的阶段性付款,如产品成功商业化后,Precision还将获得商品销售分成。
一 CRISPR基因编辑 VS ARCUS基因编辑
1、CRISPR基因编辑技术
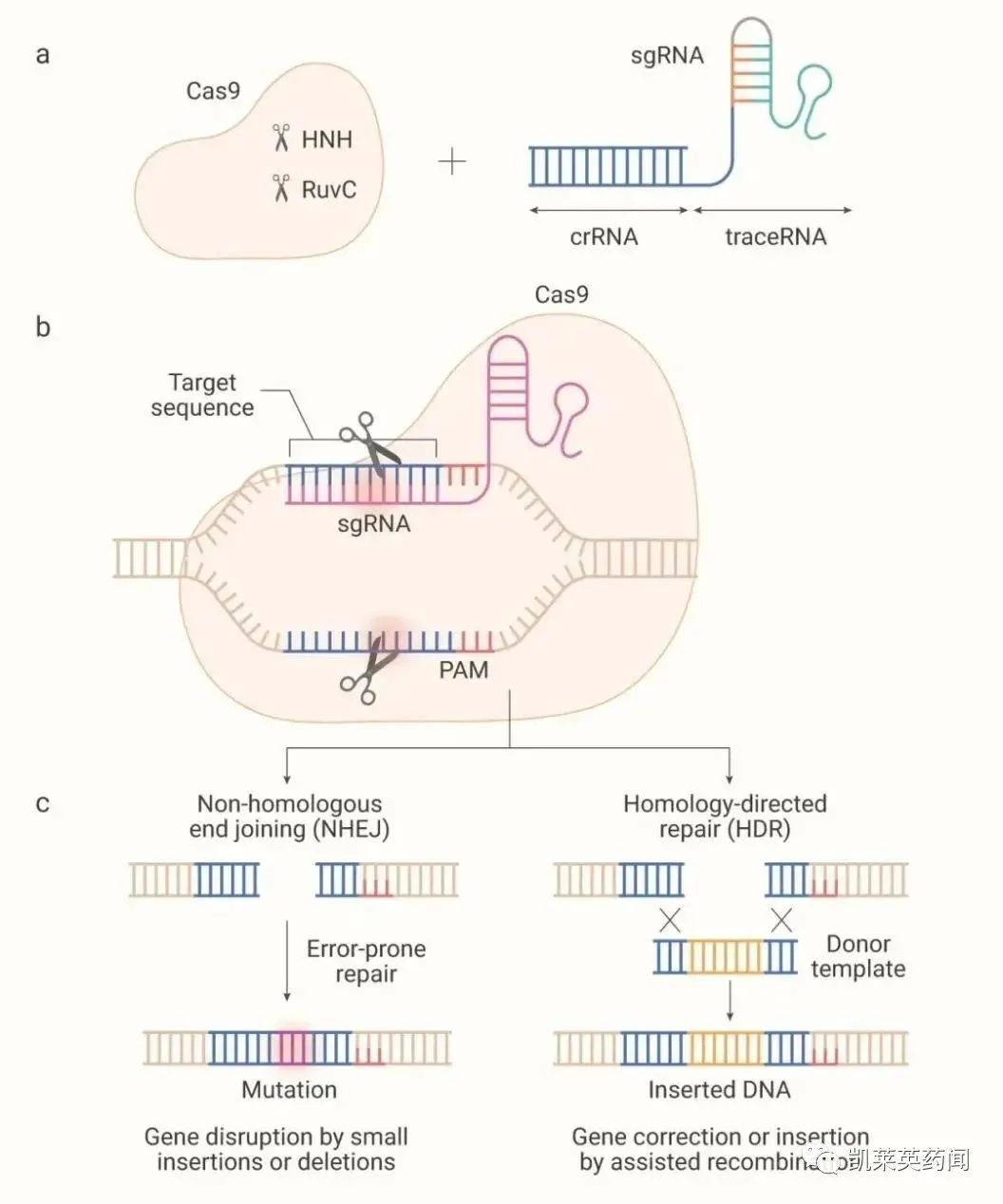
2、ARCUS基因组编辑技术
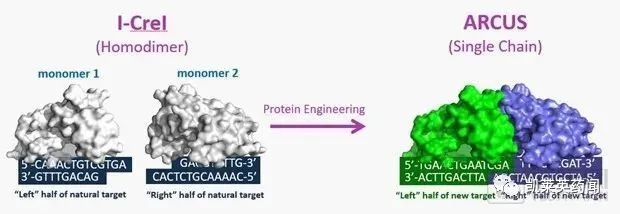

二 基因编辑疗法在治疗SCD疾病方面将迎来里程碑进展
1、镰刀细胞病至今获批疗法有限
镰状细胞病(SCD)又叫镰刀型细胞贫血症,是最常见的单基因病,是由于β基因发生单一碱基突变--正常β基因第6个密码子GAA变为GTA,导致正常编码的谷氨酸变为缬氨酸,正常的血红蛋白(HbA)变为镰形细胞的血红蛋白(HbS),红细胞由正常的圆饼状变为弯曲的镰刀状。镰状红细胞存在输氧功能缺陷,容易破裂而造成血管堵塞,诱发严重贫血,甚至引起病人死亡。临床表现为贫血、反复感染和周期性疼痛等。
近年来SCD发病率越来越高,年发病率约为1/300,000,有机构预测这个数字2050年会增加到1/40,000。据估计,目前在美国大约有 10 万名 SCD 患者,平均预期寿命为40-60岁。
目前获批治疗SCD的药物有限,仅有Hydroxyurea(羟基脲)和Endari(L-谷氨酰胺口服粉剂),Hydroxyurea作为一种老旧的化疗药物会引起严重的毒副反应,有一定的致癌风险。Emmaus Medical公司研发的Endari 2017年获批上市,是近 20年来第一个获得批准用于SCD患者的治疗药物。此外,SCD患者还可以选择输血或者干细胞移植,目前干细胞移植被证明是目前唯一可治愈SCD的疗法,但由于难以找到匹配的供体,干细胞移植疗法挑战也极大。
2、2023年基因编辑疗法治疗SCD有望迎来重要“里程碑”
目前治疗SCD进入临床阶段的基因编辑疗法共11个,其中Blue Bird公司的lovo-cel疗法与Vertex & CRISPR Therapeutics的Exa-cel疗法已进入上市前期准备阶段,如成功获批,有望迎来“里程碑”进展。
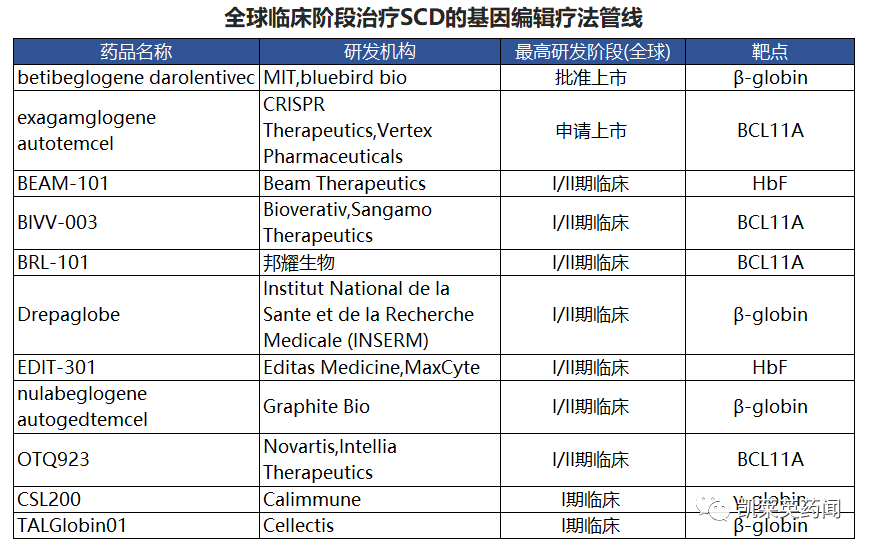
(1)lovo-cel—Blue Bird公司
lovo-cel是一种一次性的SCD基因疗法。Lovo-cel是一款基于慢病毒的用于治疗镰状细胞贫血病(SCD)的自体干细胞疗法,通过慢病毒载体将具备功能的人βA-T87Q-珠蛋白基因拷贝至取自患者体内的造血干细胞中,再将这些干细胞回输到患者体内,使其自主生成β-珠蛋白,从而消除或大幅降低继续输血需求。经多次被FDA临床搁置,根据公司最新财报披露预计将于今年一季度提交BLA。
(2)Exa-cel—Vertex & CRISPR Therapeutics
Exa-cel是一种体外基因疗法,是一种潜在的一次性治疗SCD和输血依赖型β -地中海贫血的药物,使用CRISP/Cas9编辑患者自身的造血干细胞,以产生高水平的胎儿血红蛋白,已获得了FDA的滚动审查,目前Vertex制药公司和CRISPR Therapeutics公司正在为excel -cel的批准和随后的上市做准备。
即使基因疗法即将迎来“曙光”,但作为前沿疗法后续还应关注其安全性隐患,值得注意的是Graphite Bio公司本周四宣布因为一名患者在接受治疗后出现长时间的低血细胞计数,该公司决定暂停SCD基因治疗试验。
总结
在SCD治疗领域,2019年诺华(Novartis)曾获批了一款用于预防SCD所致疼痛性血管闭塞性危象(VOC)的靶向疗法--Adakveo,之后诺华持续对Adakveo开展临床研究计划将适应症扩大到SCD,但在今年1月27日,在一项III期研究中Adakveo未能降低SCD患者血管闭塞危像的发生率,诺华正与监管机构合作确定下一步的计划。
如诺华有一款治疗SCD药物上市,可与Adakveo现有销售业务组合发力,会为诺华创造广阔的市场前景,但随着Adakveo针对SDC临床失败、 Intellia在SDC药物研发方面不及预期,以及相关竞争管线陆续进入上市前期,诺华可能转向通过ARCUS核酸酶加速推动SCD基因治疗药物的研发进程,或者将研发费用转向其他基因缺陷疾病的开发。
参考资料:
1、公司官网
2、动脉网、中洪博元生物、医药魔方